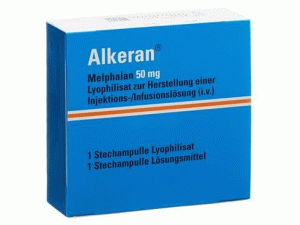
马法兰冻干粉注射剂Alkeran Trockensubstanz 50mg
 药店国别:
产地国家:瑞士
处方药:是
所属类别: 50毫克/瓶
包装规格: 50毫克/瓶
计价单位:瓶
生产厂家中文参考译名:
生产厂家英文名:Aspen Pharma Schweiz GmbH
原产地英文商品名:Alkeran Trockensubstanz 50mg C Solv Ampullen
原产地英文药品名:Melphalan
中文参考商品译名:Alkeran冻干粉注射剂 50毫克/瓶
中文参考药品译名:马法兰
曾用名:
简介:部份中马法兰文处方资料(仅供参考)马法兰注射液(Melphalan)说明书定量与定性组成注射剂为单元盒装,每盒中装有一个内含50毫克无菌无水melphalan的小瓶,以及一个内含稀释溶剂的小瓶。剂型附有溶剂的冻晶干燥注射剂。
适应症
局部恶性黑色素瘤,软组织肉瘤,多发性骨髓瘤,卵巢癌,神经母细胞瘤。说明以局部动脉灌流(regional arterialperfusion)给予Alkeran注射剂,用于治疗四肢之局部恶性黑色素瘤(local ised mal ignnantmelanoma)及局部性软组织肉瘤(local ised soft tissuesarcoma).以一般静脉剂量给予Alkeran注射剂可用于治疗:多发性骨髓瘤(multiplemyeloma),单独使用Alkeran注射剂,或与其它细胞毒性药物并用于治疗多发性骨髓瘤之效果与口服剂型相当。卵巢癌(ovariancancer),单独使用Alkeran注射剂或与其它细胞毒性药物并用时,对大约50%患恶性卵巢腺癌(advanced ovarian
adenocarcinoma)之患者有良好反应(objectiveresponse).以高剂量静脉给予Alkeran注射剂可用以治疗:多发性骨髓瘤:伴随或无伴随体髓骨髓回复(autologous bone marrow
rescue)作为第一线治疗,或用于强化对传统细胞的抑制性化学治疗之反应的病患,接受高剂量Alkeran注射剂,有50%可达到完全缓解。孩童之神经细胞瘤(neuroblastoma),伴随自体髓骨髓回复,单独使用高剂量Alkeran注射剂或并用放射腺疗法和其他细胞毒性药物的治疗,已用于强化对传统治疗的反应,在一项接受高剂量Alkeran注射剂的前瞻性随机试验中,和不接受进一步的病患比较,已证实能有意义的增加无病生存期。
用量与用法
本药限于医师使用。Alkeran为具细胞毒性药物,属于一般羟基化剂(alkylatingagents)的一种,应只可由这类药物治疗恶性肿瘤疾病经验的医师指示使用。因Alkeran具有骨髓抑制作用,治疗期间因随时监测血球数目,并且在需要延迟给药或调整剂量(参看注意事项)。
多发性骨髓瘤:Alkeran注射剂已用于单独间歇性使用,或和其他细胞毒性药物并用,剂量介于每平方公尺体表面积8至30公丝之间,给药间隔为2至6个星期。此外,许多疗程都包括给予prednisone,有关治疗疗程之正确细节应查于文献。单独使用时,典型静脉剂量为每公斤体重0.4公丝(每平方公尺体表面积16公丝)并于适当给药间隔下重复给药(挒,每4个星期一次),在此时间可回复周边血球数目。高剂量疗程一般采用每平方公尺体表面积100至200公丝(约每公斤体重2.5至5公丝)的单一静脉剂量,但若超过每平方公尺体表面积140公丝的剂量时,自髓骨随回复便相当重要,肾功能不全患者,剂量应减少50%(参看肾功能不全之剂量使用)。因高剂量的Alkeran注射剂会引起严重骨髓抑制,治疗因局限于有适当设备之专业医疗中心,且只可由具经验之临床医生给药(参看注意事项)。
卵巢腺癌:若为单一静脉剂量使用,常采取每4个星期给予1公丝/公斤(约每平方公尺体表面积40公丝)的剂量。若合并其他细胞毒性药物,则静脉剂量介于每公斤体重0.3-0.4公丝(每平方公尺体表面积12-16公丝),给药间隔为4至6个星期。
恶性黑色素瘤:Alkeran之局部高体温灌流(hyperthermic regionalperfusion)已被作用为早期恶性黑色素瘤手术之辅助性治疗,以及恶性但为局部疾病之缓解治疗。灌流技术和使用剂量之细节应查询科学文献。上肢灌流的典型剂量范围为每公斤体重0.6-1.0公丝,而下肢灌流为每公斤体重0.8-1.5公丝。
软组织肉瘤:Alkeran之局部高体温灌流已被用于局部软组织肉瘤中所有阶段的处理方式,通常和外科手术合并,Alkeran也和ActinomycinD并用,剂量给发之细节应查于科学文献。上肢灌流的典型剂量范围为每公斤体重0.6-1.0公丝,而下肢灌流为每公斤体重1.0-1.4公丝.
恶性神经母细胞瘤:剂量介于每平方公尺体表面积100至240公丝之间(有时分等剂量持续3天给药),伴随自髓骨随回复,并采单独或合并放射治疗和其他细胞毒性药物使用。
马法兰冻干粉注射剂英文版说明书
Alkeran Trockensubstanz 50mg C Solv AmpullenFachinformationenZusammensetzungWirkstoff: Melphalanum.Hilfsstoffe (Filmtabletten): Excipiens pro compresso obducto.Hilfsstoffe (Injektions-/Infusionspräparat): Praeparatio cryodesiccata: Acidum hydrochloricum und Polyvidonum K 12.Solvens: Natrii citras, Propylenglycolum, Ethanolum und Aqua ad solutionem.Galenische Form und Wirkstoffmenge pro EinheitFilmtabletten: 2 mg Melphalan.Injektions-/Infusionspräparat: Stechampulle mit Lyophilisat zu 50 mg Melphalan. Stechampulle mit 10 ml Lösungsmittel.Indikationen/AnwendungsmöglichkeitenMultiples Myelom.Fortgeschrittenes Ovarialkarzinom.Mammakarzinom.Alkeran kann in Mono- oder Kombinationstherapie beim fortgeschrittenen Mamma-Karzinom eine therapeutische Wirkung haben.Regionale arterielle Perfusion bei lokalisiertem, malignem Melanom oder Weichteilsarkom der Extremitäten.Polycythaemia rubra vera: Alkeran hat sich bei einigen Patienten als wirksam erwiesen.Hochdosiertes Alkeran i.v. als Vorbereitung zur hämopoetischen Stammzell-Transplantation wird entweder allein oder in Kombination mit Radiotherapie und/oder mit anderen zytostatischen Mitteln angewendet zur Konsolidierung des mit konventioneller Behandlung erreichten Resultates bei Neuroblastom bei Kindern und Jugendlichen und bei Multiplem Myelom.Dosierung/AnwendungAlkeran ist ein zytotoxisches Medikament, das zur Klasse der alkylierenden Substanzen gehört. Es sollte daher nur von Spezialisten verwendet werden.Die Alkeran-Filmtabletten sind nüchtern einzunehmen.Die Filmtabletten sollen nicht geteilt oder zerstossen werden. Unmittelbar nach dem Kontakt mit den Filmtabletten sollen die Hände gewaschen werden. Es ist darauf zu achten, dass allfällige Tablettenteilchen (z.B. bei einer Beschädigung einer Filmtablette) nicht eingeatmet werden und nicht mit der Haut oder Schleimhaut in Kontakt kommen. Falls es zu einem Hautkontakt kommt, ist die Stelle mit Wasser und Seife zu waschen, bei Augenkontakt ist mit Wasser zu spülen.Multiples MyelomOrale ApplikationEin typisches perorales Dosierungsschema ist 0,15 mg/kg/die in geteilten Dosen über 4 Tage. Diese Behandlung wird alle 6 Wochen wiederholt.Zahlreiche Dosierungsschemen wurden beschrieben und sollten im Detail in der wissenschaftlichen Literatur nachgelesen werden.Die gleichzeitige Gabe von Alkeran und Prednison kann wirksamer sein als eine alleinige Alkeran-Therapie. Die Kombinationstherapie wird üblicherweise intermittierend durchgeführt.Bei Patienten, die auf Alkeran angesprochen haben, scheint eine Fortsetzung der Therapie über ein Jahr hinaus die Resultate nicht zu verbessern.i.v. ApplikationAlkeran wurde im Intervall von 2–6 Wochen entweder allein oder in Kombination mit anderen Zytostatika in einer Dosierung zwischen 8 und 30 mg/m² Körperoberfläche resp. 0,2–0,75 mg/kg KG i.v. verabreicht. Zusätzlich wurde in einigen Therapieschemen Prednison mit eingeschlossen – dazu sollte die Literatur konsultiert werden. Wird Alkeran als Monotherapie verwendet, ist die übliche Dosierung 0,4 mg/kg (16 mg/m²) i.v. Die Behandlung wird in entsprechenden Intervallen, z.B. alle 4 Wochen wiederholt, vorausgesetzt, dass das periphere Blutbild sich zwischenzeitlich erholt hat.Bei der hochdosierten i.v. Applikation werden Einzeldosen zwischen 100 und 200 mg/m² Körperoberfläche (ca. 2,5–5,0 mg/kg) verwendet. Wird eine Dosis über 140 mg/m² gewählt, ist die hämopoetische Stammzell-Transplantation unbedingt erforderlich. Ist die Nierenfunktion eingeschränkt, sollte die Dosis um 50% reduziert werden. In Anbetracht der schweren Myelosuppression durch das hochdosierte Alkeran i.v. sollte die Behandlung nur an speziellen Zentren und durch Spezialisten durchgeführt werden. Sie wird in der Regel nur bis zum Alter von 60 Jahren angewendet.Fortgeschrittenes OvarialkarzinomOrale ApplikationEin typisches perorales Dosierungsschema ist 0,2 mg/kg/die über 5 Tage. Dieses Schema wird alle 4 bis 8 Wochen wiederholt, oder sobald sich das periphere Blut erholt hat.i.v. ApplikationWird Alkeran in Monotherapie verwendet, ist eine übliche Dosierung 1 mg/kg (ca. 40 mg/m²) i.v., verabreicht im Intervall von 4 Wochen. In einer Kombinationstherapie werden hingegen 0,3 oder 0,4 mg/kg (12–16 mg/m²) i.v. im Intervall von 4–6 Wochen verwendet.MammakarzinomDie orale Gabe von 0,15 mg/kg oder 6 mg/m² über 5 Tage wird alle 6 Wochen wiederholt. Bei Auftreten einer Knochenmarkstoxizität wird die Dosis reduziert.Regionale arterielle Perfusion in Hyperthermie bei malignem Melanom und WeichteilsarkomDosierungen und Perfusionstechniken sollten der aktuellen wissenschaftlichen Literatur entnommen werden.Polycythaemia rubra veraDie übliche perorale Dosis zur Remissionsinduktion ist 6–10 mg/die über 5–7 Tage. Danach werden 2–4 mg/die verabreicht, bis eine zufriedenstellende Kontrolle der Erkrankung erreicht ist. Die Therapie wird dann mit Dosen von 2–6 mg 1× pro Woche aufrechterhalten.Da es bei einer Langzeittherapie mit Alkeran zu einer schweren Myelosuppression kommen kann, ist eine regelmässige Blutbildkontrolle mit der entsprechenden Dosisanpassung oder einem Therapieunterbruch unbedingt nötig.Fortgeschrittenes Neuroblastom (Kinder und Jugendliche)Dosen zwischen 100 und 240 mg/m² Körperoberfläche i.v. (manchmal verteilt auf 3 aufeinanderfolgende Tage) zusammen mit einer hämopoetischen Stammzell-Transplantation wurden in Kombination mit Chirurgie, Radiotherapie oder anderen Zytostatika verabreicht.Spezielle DosierungsanweisungenÄltere PatientenObwohl Alkeran in der konventionellen Dosierung beim älteren Patienten häufig verwendet wird, gibt es keine speziellen Daten. Erfahrung in der Anwendung von Alkeran hochdosiert i.v. bei älteren Patienten gibt es kaum. Deshalb sollten auch der allgemeine Zustand und die Organfunktion berücksichtigt werden, bevor Alkeran i.v. hochdosiert verwendet wird.Dosierung bei NiereninsuffizienzDie Alkeran Clearance kann bei Niereninsuffizienz vermindert sein. Bei Patienten mit mässiger bis schwerer Niereninsuffizienz sollte die Initialdosis von Alkeran in konventioneller Dosierung i.v. (8–40 mg/m²) um 50% reduziert werden. Die folgenden Dosen sollten entsprechend den Ergebnissen der Blutbildkontrollen festgelegt werden.Bei hochdosiertem Alkeran i.v. (100–240 mg/m²) ist die Notwendigkeit einer Dosisreduktion abhängig vom Grad der Niereninsuffizienz, ob die hämopoetischen Stammzellen wieder infundiert werden und von der therapeutischen Notwendigkeit.Im Allgemeinen ist eine 50%-ige Dosisreduktion bei der hochdosierten Alkeran-Behandlung ohne Transplantation hämopoetischer Stammzellen bei Patienten mit mässig eingeschränkter Nierenfunktion (Kreatinin-Clearance zwischen 30 und 50 ml/min) üblich. Bei Patienten mit stärker eingeschränkter Nierenfunktion ist eine hochdosierte Alkeran-Behandlung ohne hämopoetische Stammzell-Transplantation nicht zu empfehlen. Die hochdosierte Alkeran-Behandlung mit hämopoetischer Stammzell-Transplantation wurde bei Dialysepatienten mit Niereninsuffizienz im Endstadium mit Erfolg angewandt. Einzelheiten sind der spezifischen Fachliteratur zu entnehmen.Anweisung für die parenterale ApplikationNach erfolgter Auflösung der Alkeran-Trockensubstanz kann die Verabreichung der Lösung als intravenöse Injektion oder Infusion sowie mittels regionalem Perfusionsverfahren erfolgen (siehe «Sonstige Hinweise»/«Hinweise für die Handhabung»).KontraindikationenAlkeran sollte nicht an Patienten mit bekannter Überempfindlichkeit gegenüber Melphalan oder einem der Hilfsstoffe verabreicht werden.Warnhinweise und VorsichtsmassnahmenAlkeran sollte nur von einem in der zytostatischen Therapie erfahrenen Arzt angewendet werden.Bei Extravasaten mit Alkeran i.v. kann lokal eine Weichteilläsion auftreten; daher sollte die Injektion nicht direkt in eine periphere Vene erfolgen. Es wird empfohlen, die Alkeran-Lösung in den Schlauch einer schnell fliessenden Infusion zu injizieren oder verdünnt in NaCl 0,9% zu verabreichen. Bei schlechten peripheren Venen sollte eventuell ein Zentral-Venenkatheter verwendet werden.Die Applikation von hochdosiertem Alkeran sollte in Anbetracht der möglichen Risiken und der erforderlichen Pflege nur durch Spezialisten und in einem spezialisierten Zentrum verwendet werden. Patienten mit hochdosiertem Alkeran müssen eventuell gegen Infekte prophylaktisch abgeschirmt und mit Blutprodukten substituiert werden.Bevor hochdosiertes Alkeran i.v. verwendet wird, sollten der Allgemeinzustand und die Organfunktion berücksichtigt werden.Alkeran ist eine stark myelosuppressive Substanz. Daher muss während und nach der Therapie mit Alkeran eine sorgfältige Überwachung des Blutbildes erfolgen, um eine exzessive Knochenmarksdepression und das Risiko einer irreversiblen Knochenmarksaplasie zu vermeiden.Da die Blutbildwerte auch nach Beendigung der Alkeran-Gabe noch weiter absinken können, sollte die Therapie bereits beim ersten Anzeichen eines anormal starken Abfalls der Leukozyten- oder Thrombozytenzahl unterbrochen werden.Bei Patienten mit vorangegangener Strahlen- oder Chemotherapie darf Alkeran im Hinblick auf die erhöhte Knochenmarkstoxizität nur mit besonderer Vorsicht eingesetzt werden.Bei der peroralen Einnahme ist die Absorption von Alkeran sehr variabel, daher kann es nötig sein, die Dosis vorsichtig anzupassen bis zur Myelosuppression, um sicher zu sein, dass die therapeutische Plasmakonzentration erreicht ist.Während einer Therapie mit Alkeran durchgeführte Impfungen können aufgrund der Immunsuppression wirkungslos sein. Impfungen mit Lebendimpfstoffen werden wegen der Gefahr einer Infektion nicht empfohlen.KarzinogenitätWie andere alkylierende Substanzen ist Melphalan beim Menschen leukämogen. Nach längerer Alkeran-Behandlung wurden akute Leukämien beschrieben: bei malignem Melanom, multiplem Myelom und Ovarialkarzinom. Ein Vergleich mit oder ohne Alkylanzien-Therapie – einschliesslich Melphalan – beim Ovarialkarzinom zeigte, dass als Folge der Therapie die Inzidenz akuter Leukämien signifikant erhöht ist. Daher sollte vor der Anwendung von Melphalan das leukämogene Risiko dem potentiellen therapeutischen Nutzen gegenübergestellt werden.Patienten mit NierenschädenDie Alkeran-Clearance kann bei Patienten mit Niereninsuffizienz, die auch eine urämische Knochenmarkssuppression haben können, reduziert sein. Eine Dosisreduktion kann daher nötig sein und diese Patienten müssen engmaschig kontrolliert werden (siehe auch «Dosierung bei Niereninsuffizienz»).Warnhinweise und VorsichtsmassnahmenAlkeran sollte nur von einem in der zytostatischen Therapie erfahrenen Arzt angewendet werden.Bei Extravasaten mit Alkeran i.v. kann lokal eine Weichteilläsion auftreten; daher sollte die Injektion nicht direkt in eine periphere Vene erfolgen. Es wird empfohlen, die Alkeran-Lösung in den Schlauch einer schnell fliessenden Infusion zu injizieren oder verdünnt in NaCl 0,9% zu verabreichen. Bei schlechten peripheren Venen sollte eventuell ein Zentral-Venenkatheter verwendet werden.Die Applikation von hochdosiertem Alkeran sollte in Anbetracht der möglichen Risiken und der erforderlichen Pflege nur durch Spezialisten und in einem spezialisierten Zentrum verwendet werden. Patienten mit hochdosiertem Alkeran müssen eventuell gegen Infekte prophylaktisch abgeschirmt und mit Blutprodukten substituiert werden.Bevor hochdosiertes Alkeran i.v. verwendet wird, sollten der Allgemeinzustand und die Organfunktion berücksichtigt werden.Alkeran ist eine stark myelosuppressive Substanz. Daher muss während und nach der Therapie mit Alkeran eine sorgfältige Überwachung des Blutbildes erfolgen, um eine exzessive Knochenmarksdepression und das Risiko einer irreversiblen Knochenmarksaplasie zu vermeiden.Da die Blutbildwerte auch nach Beendigung der Alkeran-Gabe noch weiter absinken können, sollte die Therapie bereits beim ersten Anzeichen eines anormal starken Abfalls der Leukozyten- oder Thrombozytenzahl unterbrochen werden.Bei Patienten mit vorangegangener Strahlen- oder Chemotherapie darf Alkeran im Hinblick auf die erhöhte Knochenmarkstoxizität nur mit besonderer Vorsicht eingesetzt werden.Bei der peroralen Einnahme ist die Absorption von Alkeran sehr variabel, daher kann es nötig sein, die Dosis vorsichtig anzupassen bis zur Myelosuppression, um sicher zu sein, dass die therapeutische Plasmakonzentration erreicht ist.Während einer Therapie mit Alkeran durchgeführte Impfungen können aufgrund der Immunsuppression wirkungslos sein. Impfungen mit Lebendimpfstoffen werden wegen der Gefahr einer Infektion nicht empfohlen.KarzinogenitätWie andere alkylierende Substanzen ist Melphalan beim Menschen leukämogen. Nach längerer Alkeran-Behandlung wurden akute Leukämien beschrieben: bei malignem Melanom, multiplem Myelom und Ovarialkarzinom. Ein Vergleich mit oder ohne Alkylanzien-Therapie – einschliesslich Melphalan – beim Ovarialkarzinom zeigte, dass als Folge der Therapie die Inzidenz akuter Leukämien signifikant erhöht ist. Daher sollte vor der Anwendung von Melphalan das leukämogene Risiko dem potentiellen therapeutischen Nutzen gegenübergestellt werden.Patienten mit NierenschädenDie Alkeran-Clearance kann bei Patienten mit Niereninsuffizienz, die auch eine urämische Knochenmarkssuppression haben können, reduziert sein. Eine Dosisreduktion kann daher nötig sein und diese Patienten müssen engmaschig kontrolliert werden (siehe auch «Dosierung bei Niereninsuffizienz»).InteraktionenDie gleichzeitige Anwendung von Nalidixinsäure mit hochdosiertem, intravenösem Alkeran hat bei Kindern zu hämorrhagischer Enterokolitis mit letalem Ausgang geführt.Nach Knochenmarkstransplantationen bei Patienten, die mit hochdosiertem Alkeran vorbehandelt wurden, ist Nierenversagen beobachtet worden, wenn Ciclosporin zur Verhütung der «graft versus host» Reaktion gegeben wurde.Schwangerschaft/StillzeitTeratogenität: Aufgrund der Ergebnisse einer alten Studie an Ratten sowie der Ähnlichkeit mit anderen alkylierenden Substanzen mit teratogenem Potential ist das Risiko von Missbildungen nicht auszuschliessen.Die Anwendung von Melphalan sollte wenn möglich während der Schwangerschaft vermieden werden, besonders während des ersten Trimenon. Bei jedem Fall muss individuell das potentielle Risiko für den Fötus gegenüber dem zu erwartenden Nutzen für die Mutter abgewogen werden.Wie bei jeder zytotoxischen Chemotherapie werden kontrazeptive Massnahmen empfohlen, wenn einer der Partner mit Alkeran behandelt wird.Während der Therapie mit Alkeran sollte nicht gestillt werden.Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Aufgrund der unerwünschten Wirkungen wie Übelkeit und Erbrechen ist beim Lenken von Fahrzeugen und Bedienen von Maschinen Vorsicht geboten.Unerwünschte WirkungenDie Inzidenz der unerwünschten Wirkungen hängt von der Indikation, der gewählten Dosierung und der Komedikation ab.Die beobachteten unerwünschten Wirkungen wurden anhand ihrer Häufigkeit wie folgt klassifiziert: Sehr häufig (>1/10), häufig (>1/100, <1/10), gelegentlich (>1/1'000, <1/100), selten (>1/10'000, <1/1'000), sehr selten (<1/10'000).Blut- und LymphsystemSehr häufig: Leukopenie, Thrombozytopenie und Anämie.Selten: Hämolytische Anämie.ImmunsystemGelegentlich: Allergische Reaktionen (siehe auch «Haut und Unterhautzellgewebe») mit Symptomen wie Urtikaria, Ödemen, Hautexanthemen und anaphylaktischem Schock nach Verabreichung von Initial- oder Erhaltungsdosis, insbesondere nach intravenöser Applikation.Selten wurde in diesem Zusammenhang auch von einem Herzstillstand berichtet.AtmungsorganeSelten: Interstitielle Pneumonie und Lungenfibrose (einschliesslich tödlich verlaufende Fälle).Gastrointestinale StörungenSehr häufig: Übelkeit und Erbrechen (je 30% bei konventioneller Dosis), Durchfall, Stomatitis bei hoher Dosierung.Selten: Stomatitis bei konventioneller Dosierung.Bei Patienten, die hochdosiert Alkeran in Verbindung mit einer autologen Knochenmarkstransplantation erhalten, ist die erhöhte Inzidenz von Diarrhö, Erbrechen und Stomatitis der Dosis limitierende Faktor. Eine Vorbehandlung mit Cyclophosphamid kann die gastrointestinalen Störungen bei hochdosiertem Alkeran mildern (Details sind der Literatur zu entnehmen).Leber und GalleSelten: Leberfunktionsstörungen verschiedenster Natur von abnormen Werten bei Leberfunktionstests bis zu klinischen Manifestationen wie Hepatitis und Ikterus; Lebervenenverschlusskrankheit (VOD) unter hohen parenteralen Dosen.Haut und UnterhautzellgewebeSehr häufig: Alopezie bei hoher Dosierung.Häufig: Alopezie bei konventioneller Dosierung.Selten: Makulopapulöses Exanthem, Pruritus (siehe «Immunsystem»).Muskel- und SkelettsystemBei regionaler arterieller PerfusionSehr häufig: Muskelatrophie, Muskelfibrose, Myalgie, erhöhte Kreatin-Phosphokinase im Blut.Häufig: Kompartementsyndrom.Muskelnekrose, Rhabdomyolyse.Nieren und HarnwegeHäufig: Vorübergehender signifikanter Anstieg der Harnstoff-Werte im Blut zu Beginn einer Melphalan-Therapie bei Myelom-Patienten mit vorbestehendem Nierenschaden.Reproduktionssystem und BrustHemmung der Ovarialfunktion, was bei der Mehrzahl der in der Prämenopause behandelten Patientinnen zu einer Amenorrhö führt.Vorübergehende oder dauernde Sterilität bei männlichen Patienten.Reaktionen an der ApplikationsstelleSehr häufig: Subjektives und vorübergehendes Wärmegefühl und/oder leichtes Brennen an der Injektionsstelle (66%).ÜberdosierungZeichen einer akuten Überdosierung sindNach oraler Überdosierung treten gastrointestinale Nebenwirkungen auf, wie Nausea, Erbrechen und Diarrhö. Die unmittelbaren Nebenwirkungen einer akuten intravenösen Überdosierung sind Nausea und Erbrechen. Es kann auch zu einer gastrointestinalen Mucosa-Schädigung kommen und zu einer manchmal hämorrhagischen Diarrhö. Die Hauptnebenwirkung ist jedoch eine Knochenmark-Suppression, die zu Leukopenie, Thrombozytopenie und Anämie führt.Behandlung der akuten ÜberdosierungUnterstützende Allgemeinmassnahmen und wenn nötig Blut- und Thrombozyten-Transfusionen sind einzuleiten. Es sollen weiter eine Hospitalisation, Antibiotika-Schutz und die Anwendung hämatologischer Wachstumsfaktoren in Erwägung gezogen werden.Ein spezifisches Antidot gibt es nicht. Bis zur Erholung sollte das Blutbild sorgfältig kontrolliert werden.Eigenschaften/WirkungenATC-Code: L01AA03Melphalan ist ein Stickstoff-Lost Derivat und gehört zu den bifunktionellen Alkylantien. Durch Aktivierung der beiden 2-Chloroäthylgruppen kommt eine kovalente Bindung zwischen N7 des DNS-Guanins zustande. Die Vernetzung zweier DNS-Stränge blockiert die Zellreplikation.PharmakokinetikAbsorptionDie orale Absorption von Melphalan ist individuell sehr verschieden. Die absolute Bioverfügbarkeit beträgt zwischen 56 und 85%. Die maximale Plasmakonzentration wird innerhalb von 0,5–2 Stunden erreicht. Wird Alkeran unmittelbar nach einer Mahlzeit verabreicht, verlängert sich die Zeit bis zum Erreichen der maximalen Plasmakonzentration und die Fläche unter der Konzentrationszeitkurve (AUC) wird um 39–45% reduziert.DistributionDas mittlere Verteilungsvolumen im Steady-State schwankt erheblich je nach Dosierung und beträgt ca. 40 ± 18 l. Der Übertritt in den Liquor ist gering. Die Bindung an Plasmaproteine beträgt 69–78% und erfolgt hauptsächlich an Albumin (55–60%) und weniger an α1-saures Glykoprotein (20%). Ca. 30% der Substanz ist irreversibel an Plasmaproteine gebunden (Alkylierung) bei Standarddosierung ist die Plasmaproteinbindung konzentrationsunabhängig. Bei Hochdosistherapie kann sie konzentrationsabhängigkeit sein. Es ist nicht bekannt, ob Melphalan plazentagängig ist oder ob es in die Muttermilch übertritt.MetabolismusNach Injektion von Melphalan wurden Monohydroxymelphalan und Dihydroxymelphalan im Plasma der Patienten nachgewiesen. Die maximale Plasmakonzentration dieser Metaboliten wurde nach 60 bzw. 105 min erreicht.Eine ähnliche Halbwertszeit (siehe «Elimination») wurde beobachtet, wenn Melphalan dem Patienten-Serum in vitro (bei 37 °C) zugegeben wurde, was darauf hinweist, dass der wichtigste Faktor der Halbwertszeit beim Menschen eher der spontane Abbau als der enzymatische Metabolismus ist.EliminationDie mittlere terminale Plasmahalbwertszeit nach oraler Gabe von 0,6 mg/kg KG Melphalan betrug 90 ± 57 min. 11% der Substanz wurden innerhalb von 24 h unverändert im Urin nachgewiesen. Nach oraler Verabreichung von 0,2–0,25 mg/kg KG betrug die mittlere Eliminationshalbwertszeit 1,12 ± 0,15 h.Die Pharmakokinetik von Melphalan i.v. nach konventionellen und nach hohen Dosen wird am besten durch ein bi-exponentielles 2-Kompartiment-Modell beschrieben.Nach einer hyperthermen Perfusion (39 °C) und nach einer Dosierung von 1,75 mg/kg betrug die mittlere initiale Halbwertszeit 3,6±1,5 min bzw. die terminale Halbwertszeit 46,5 ± 17,2 min.In verschiedenen Studien sind die Werte der Clearance unterschiedlich, entsprechend der Höhe der Dosierung. Bei hochdosierten i.v. Applikationen von 140 mg/m² war die mittlere Clearance 564±159 ml/min. Der Q0-Wert wird mit 0,9 angegeben.Kinetik spezieller PatientengruppenDie Kinetik bei älteren Patienten und konventioneller Dosierung ist unverändert, bei hohen Alkeran Dosen i.v. liegen bisher keine Daten vor.Bei Niereninsuffizienz kann die Melphalan-Clearance erniedrigt sein.Präklinische DatenMutagenitätAlkeran ist im Tierversuch mutagen. Bei behandelten Patienten wurden Chromosomen-Aberrationen beobachtet.KarzinogenitätMelphalan wurde in Karzinogenitätstests an Ratten und Mäusen bei intraperitonealer Injektion geprüft. In Ratten induzierte die Behandlung peritoneale Sarkome und in Mäusen führte sie zu Lymphosarkomen und dosisabhängig erhöhten Inzidenzen von Lungentumoren.TeratogenitätIn einer alten Studie an Ratten führte die Behandlung mit Melphalan zu einer erhöhten Inzidenz von Missbildungen.Sonstige HinweiseInkompatibilitätenDas Lyophilisat darf nur mit dem beigepackten Lösungsmittel aufgelöst und die rekonstituierte Lösung nur mit dem unter «Hinweise für die Handhabung» genannten Arzneimittel gemischt werden.Haltbarkeit/Besondere LagerungshinweiseFilmtabletten: Im Kühlschrank (2–8 °C) lagern.Injektions-/Infusionspräparat (Lyophilisat und Lösungsmittel): Nicht über 30 °C und vor Licht geschützt in der Originalpackung lagern. Nicht im Kühlschrank lagern, sonst kann es bei der Zubereitung der Infusionslösung zur Ausflockung von Melphalan kommen.Die Lösungen (unverdünnt und verdünnt) haben eine beschränkte Stabilität und sollten daher unmittelbar vor Verwendung hergestellt werden. Zwischen der Zubereitung der verdünnten Infusionslösung und dem Infusionsende sollte eine Zeitspanne von 1½ Stunden nicht überschritten werden. Nicht verwendete Lösungen sollen entsorgt werden.Die Arzneimittel dürfen nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.Hinweise für die HandhabungHerstellung der Alkeran-InjektionslösungDie Herstellung der Alkeran-Injektionslösung erfolgt bei Raumtemperatur. Das Lyophilisat wird mit dem Lösungsmittel aufgelöst. Es werden 10 ml Lösungsmittel in einer Portion zur Trockensubstanz gegeben und sofort kräftig geschüttelt, bis diese vollständig gelöst ist. Die so hergestellte Lösung enthält 5 mg/ml Melphalan und hat einen pH-Wert von ca. 6,5. Die Lösung hat eine beschränkte Stabilität und sollte daher unmittelbar vor Verwendung hergestellt werden. Nicht verwendete Lösung soll entsorgt werden. Die hergestellte Lösung sollte nicht gekühlt werden, da sonst Ausflockungen entstehen.Intravenöse Anwendung i.v.Ausgenommen in Fällen, wo eine regionale arterielle Perfusion indiziert ist, wird Alkeran nur intravenös verwendet. Es ist empfehlenswert, Alkeran i.v. langsam in den Schlauch einer rasch fliessenden i.v. Infusion zu injizieren. Ist dies nicht möglich, ist Alkeran in eine i.v. Infusion zu geben. Die rekonstituierte Lösung sollte mit einer NaCl 0,9%-Infusionslösung verdünnt werden, so dass die Melphalan-Konzentration 0,45 mg/ml nicht übersteigt. Als Infusionslösung sollte nur NaCl 0,9% verwendet werden, keine Glukose-Infusion. Wird Alkeran mit einer Infusionslösung weiter verdünnt, nimmt die Stabilität ab und die Degradation mit zunehmender Temperatur rasch zu. Wird Alkeran bei Raumtemperatur (ca. 25 °C) infundiert, sollte die Zeitspanne zwischen der Vorbereitung bis zum Infusionsende 1½ Stunden nicht überschreiten.Tritt eine sichtbare Trübung oder Ausflockung nach Auflösen oder Verdünnen von Alkeran i.v. auf, ist die Lösung nicht zu verwenden. Die Lösung sollte streng i.v. appliziert werden, Extravasate sind zu vermeiden. Bei schlechten peripheren Venen sollte eventuell ein Zentral-Venenkatheter verwendet werden. Bei hochdosierter i.v.-Applikation mit oder ohne autologer Knochenmarkstransplantation ist ein Zentral-Venenkatheter empfehlenswert.Regionale arterielle PerfusionZum Verfahren der regionalen arteriellen Perfusion ist die Literatur zu konsultieren.Sichere Handhabung von AlkeranBei der Handhabung von Alkeran, der Zubereitung der Injektions-/Infusionslösung und der Entsorgung sind die Richtlinien für Zytostatika zu befolgen (für Filmtabletten siehe auch «Dosierung/Anwendung»).Zulassungsnummer30897, 52193 (Swissmedic).ZulassungsinhaberinAspen Pharma Schweiz GmbH, Baar.
药店国别:
产地国家:瑞士
处方药:是
所属类别: 50毫克/瓶
包装规格: 50毫克/瓶
计价单位:瓶
生产厂家中文参考译名:
生产厂家英文名:Aspen Pharma Schweiz GmbH
原产地英文商品名:Alkeran Trockensubstanz 50mg C Solv Ampullen
原产地英文药品名:Melphalan
中文参考商品译名:Alkeran冻干粉注射剂 50毫克/瓶
中文参考药品译名:马法兰
曾用名:
简介:部份中马法兰文处方资料(仅供参考)马法兰注射液(Melphalan)说明书定量与定性组成注射剂为单元盒装,每盒中装有一个内含50毫克无菌无水melphalan的小瓶,以及一个内含稀释溶剂的小瓶。剂型附有溶剂的冻晶干燥注射剂。
适应症
局部恶性黑色素瘤,软组织肉瘤,多发性骨髓瘤,卵巢癌,神经母细胞瘤。说明以局部动脉灌流(regional arterialperfusion)给予Alkeran注射剂,用于治疗四肢之局部恶性黑色素瘤(local ised mal ignnantmelanoma)及局部性软组织肉瘤(local ised soft tissuesarcoma).以一般静脉剂量给予Alkeran注射剂可用于治疗:多发性骨髓瘤(multiplemyeloma),单独使用Alkeran注射剂,或与其它细胞毒性药物并用于治疗多发性骨髓瘤之效果与口服剂型相当。卵巢癌(ovariancancer),单独使用Alkeran注射剂或与其它细胞毒性药物并用时,对大约50%患恶性卵巢腺癌(advanced ovarian
adenocarcinoma)之患者有良好反应(objectiveresponse).以高剂量静脉给予Alkeran注射剂可用以治疗:多发性骨髓瘤:伴随或无伴随体髓骨髓回复(autologous bone marrow
rescue)作为第一线治疗,或用于强化对传统细胞的抑制性化学治疗之反应的病患,接受高剂量Alkeran注射剂,有50%可达到完全缓解。孩童之神经细胞瘤(neuroblastoma),伴随自体髓骨髓回复,单独使用高剂量Alkeran注射剂或并用放射腺疗法和其他细胞毒性药物的治疗,已用于强化对传统治疗的反应,在一项接受高剂量Alkeran注射剂的前瞻性随机试验中,和不接受进一步的病患比较,已证实能有意义的增加无病生存期。
用量与用法
本药限于医师使用。Alkeran为具细胞毒性药物,属于一般羟基化剂(alkylatingagents)的一种,应只可由这类药物治疗恶性肿瘤疾病经验的医师指示使用。因Alkeran具有骨髓抑制作用,治疗期间因随时监测血球数目,并且在需要延迟给药或调整剂量(参看注意事项)。
多发性骨髓瘤:Alkeran注射剂已用于单独间歇性使用,或和其他细胞毒性药物并用,剂量介于每平方公尺体表面积8至30公丝之间,给药间隔为2至6个星期。此外,许多疗程都包括给予prednisone,有关治疗疗程之正确细节应查于文献。单独使用时,典型静脉剂量为每公斤体重0.4公丝(每平方公尺体表面积16公丝)并于适当给药间隔下重复给药(挒,每4个星期一次),在此时间可回复周边血球数目。高剂量疗程一般采用每平方公尺体表面积100至200公丝(约每公斤体重2.5至5公丝)的单一静脉剂量,但若超过每平方公尺体表面积140公丝的剂量时,自髓骨随回复便相当重要,肾功能不全患者,剂量应减少50%(参看肾功能不全之剂量使用)。因高剂量的Alkeran注射剂会引起严重骨髓抑制,治疗因局限于有适当设备之专业医疗中心,且只可由具经验之临床医生给药(参看注意事项)。
卵巢腺癌:若为单一静脉剂量使用,常采取每4个星期给予1公丝/公斤(约每平方公尺体表面积40公丝)的剂量。若合并其他细胞毒性药物,则静脉剂量介于每公斤体重0.3-0.4公丝(每平方公尺体表面积12-16公丝),给药间隔为4至6个星期。
恶性黑色素瘤:Alkeran之局部高体温灌流(hyperthermic regionalperfusion)已被作用为早期恶性黑色素瘤手术之辅助性治疗,以及恶性但为局部疾病之缓解治疗。灌流技术和使用剂量之细节应查询科学文献。上肢灌流的典型剂量范围为每公斤体重0.6-1.0公丝,而下肢灌流为每公斤体重0.8-1.5公丝。
软组织肉瘤:Alkeran之局部高体温灌流已被用于局部软组织肉瘤中所有阶段的处理方式,通常和外科手术合并,Alkeran也和ActinomycinD并用,剂量给发之细节应查于科学文献。上肢灌流的典型剂量范围为每公斤体重0.6-1.0公丝,而下肢灌流为每公斤体重1.0-1.4公丝.
恶性神经母细胞瘤:剂量介于每平方公尺体表面积100至240公丝之间(有时分等剂量持续3天给药),伴随自髓骨随回复,并采单独或合并放射治疗和其他细胞毒性药物使用。
马法兰冻干粉注射剂英文版说明书
Alkeran Trockensubstanz 50mg C Solv AmpullenFachinformationenZusammensetzungWirkstoff: Melphalanum.Hilfsstoffe (Filmtabletten): Excipiens pro compresso obducto.Hilfsstoffe (Injektions-/Infusionspräparat): Praeparatio cryodesiccata: Acidum hydrochloricum und Polyvidonum K 12.Solvens: Natrii citras, Propylenglycolum, Ethanolum und Aqua ad solutionem.Galenische Form und Wirkstoffmenge pro EinheitFilmtabletten: 2 mg Melphalan.Injektions-/Infusionspräparat: Stechampulle mit Lyophilisat zu 50 mg Melphalan. Stechampulle mit 10 ml Lösungsmittel.Indikationen/AnwendungsmöglichkeitenMultiples Myelom.Fortgeschrittenes Ovarialkarzinom.Mammakarzinom.Alkeran kann in Mono- oder Kombinationstherapie beim fortgeschrittenen Mamma-Karzinom eine therapeutische Wirkung haben.Regionale arterielle Perfusion bei lokalisiertem, malignem Melanom oder Weichteilsarkom der Extremitäten.Polycythaemia rubra vera: Alkeran hat sich bei einigen Patienten als wirksam erwiesen.Hochdosiertes Alkeran i.v. als Vorbereitung zur hämopoetischen Stammzell-Transplantation wird entweder allein oder in Kombination mit Radiotherapie und/oder mit anderen zytostatischen Mitteln angewendet zur Konsolidierung des mit konventioneller Behandlung erreichten Resultates bei Neuroblastom bei Kindern und Jugendlichen und bei Multiplem Myelom.Dosierung/AnwendungAlkeran ist ein zytotoxisches Medikament, das zur Klasse der alkylierenden Substanzen gehört. Es sollte daher nur von Spezialisten verwendet werden.Die Alkeran-Filmtabletten sind nüchtern einzunehmen.Die Filmtabletten sollen nicht geteilt oder zerstossen werden. Unmittelbar nach dem Kontakt mit den Filmtabletten sollen die Hände gewaschen werden. Es ist darauf zu achten, dass allfällige Tablettenteilchen (z.B. bei einer Beschädigung einer Filmtablette) nicht eingeatmet werden und nicht mit der Haut oder Schleimhaut in Kontakt kommen. Falls es zu einem Hautkontakt kommt, ist die Stelle mit Wasser und Seife zu waschen, bei Augenkontakt ist mit Wasser zu spülen.Multiples MyelomOrale ApplikationEin typisches perorales Dosierungsschema ist 0,15 mg/kg/die in geteilten Dosen über 4 Tage. Diese Behandlung wird alle 6 Wochen wiederholt.Zahlreiche Dosierungsschemen wurden beschrieben und sollten im Detail in der wissenschaftlichen Literatur nachgelesen werden.Die gleichzeitige Gabe von Alkeran und Prednison kann wirksamer sein als eine alleinige Alkeran-Therapie. Die Kombinationstherapie wird üblicherweise intermittierend durchgeführt.Bei Patienten, die auf Alkeran angesprochen haben, scheint eine Fortsetzung der Therapie über ein Jahr hinaus die Resultate nicht zu verbessern.i.v. ApplikationAlkeran wurde im Intervall von 2–6 Wochen entweder allein oder in Kombination mit anderen Zytostatika in einer Dosierung zwischen 8 und 30 mg/m² Körperoberfläche resp. 0,2–0,75 mg/kg KG i.v. verabreicht. Zusätzlich wurde in einigen Therapieschemen Prednison mit eingeschlossen – dazu sollte die Literatur konsultiert werden. Wird Alkeran als Monotherapie verwendet, ist die übliche Dosierung 0,4 mg/kg (16 mg/m²) i.v. Die Behandlung wird in entsprechenden Intervallen, z.B. alle 4 Wochen wiederholt, vorausgesetzt, dass das periphere Blutbild sich zwischenzeitlich erholt hat.Bei der hochdosierten i.v. Applikation werden Einzeldosen zwischen 100 und 200 mg/m² Körperoberfläche (ca. 2,5–5,0 mg/kg) verwendet. Wird eine Dosis über 140 mg/m² gewählt, ist die hämopoetische Stammzell-Transplantation unbedingt erforderlich. Ist die Nierenfunktion eingeschränkt, sollte die Dosis um 50% reduziert werden. In Anbetracht der schweren Myelosuppression durch das hochdosierte Alkeran i.v. sollte die Behandlung nur an speziellen Zentren und durch Spezialisten durchgeführt werden. Sie wird in der Regel nur bis zum Alter von 60 Jahren angewendet.Fortgeschrittenes OvarialkarzinomOrale ApplikationEin typisches perorales Dosierungsschema ist 0,2 mg/kg/die über 5 Tage. Dieses Schema wird alle 4 bis 8 Wochen wiederholt, oder sobald sich das periphere Blut erholt hat.i.v. ApplikationWird Alkeran in Monotherapie verwendet, ist eine übliche Dosierung 1 mg/kg (ca. 40 mg/m²) i.v., verabreicht im Intervall von 4 Wochen. In einer Kombinationstherapie werden hingegen 0,3 oder 0,4 mg/kg (12–16 mg/m²) i.v. im Intervall von 4–6 Wochen verwendet.MammakarzinomDie orale Gabe von 0,15 mg/kg oder 6 mg/m² über 5 Tage wird alle 6 Wochen wiederholt. Bei Auftreten einer Knochenmarkstoxizität wird die Dosis reduziert.Regionale arterielle Perfusion in Hyperthermie bei malignem Melanom und WeichteilsarkomDosierungen und Perfusionstechniken sollten der aktuellen wissenschaftlichen Literatur entnommen werden.Polycythaemia rubra veraDie übliche perorale Dosis zur Remissionsinduktion ist 6–10 mg/die über 5–7 Tage. Danach werden 2–4 mg/die verabreicht, bis eine zufriedenstellende Kontrolle der Erkrankung erreicht ist. Die Therapie wird dann mit Dosen von 2–6 mg 1× pro Woche aufrechterhalten.Da es bei einer Langzeittherapie mit Alkeran zu einer schweren Myelosuppression kommen kann, ist eine regelmässige Blutbildkontrolle mit der entsprechenden Dosisanpassung oder einem Therapieunterbruch unbedingt nötig.Fortgeschrittenes Neuroblastom (Kinder und Jugendliche)Dosen zwischen 100 und 240 mg/m² Körperoberfläche i.v. (manchmal verteilt auf 3 aufeinanderfolgende Tage) zusammen mit einer hämopoetischen Stammzell-Transplantation wurden in Kombination mit Chirurgie, Radiotherapie oder anderen Zytostatika verabreicht.Spezielle DosierungsanweisungenÄltere PatientenObwohl Alkeran in der konventionellen Dosierung beim älteren Patienten häufig verwendet wird, gibt es keine speziellen Daten. Erfahrung in der Anwendung von Alkeran hochdosiert i.v. bei älteren Patienten gibt es kaum. Deshalb sollten auch der allgemeine Zustand und die Organfunktion berücksichtigt werden, bevor Alkeran i.v. hochdosiert verwendet wird.Dosierung bei NiereninsuffizienzDie Alkeran Clearance kann bei Niereninsuffizienz vermindert sein. Bei Patienten mit mässiger bis schwerer Niereninsuffizienz sollte die Initialdosis von Alkeran in konventioneller Dosierung i.v. (8–40 mg/m²) um 50% reduziert werden. Die folgenden Dosen sollten entsprechend den Ergebnissen der Blutbildkontrollen festgelegt werden.Bei hochdosiertem Alkeran i.v. (100–240 mg/m²) ist die Notwendigkeit einer Dosisreduktion abhängig vom Grad der Niereninsuffizienz, ob die hämopoetischen Stammzellen wieder infundiert werden und von der therapeutischen Notwendigkeit.Im Allgemeinen ist eine 50%-ige Dosisreduktion bei der hochdosierten Alkeran-Behandlung ohne Transplantation hämopoetischer Stammzellen bei Patienten mit mässig eingeschränkter Nierenfunktion (Kreatinin-Clearance zwischen 30 und 50 ml/min) üblich. Bei Patienten mit stärker eingeschränkter Nierenfunktion ist eine hochdosierte Alkeran-Behandlung ohne hämopoetische Stammzell-Transplantation nicht zu empfehlen. Die hochdosierte Alkeran-Behandlung mit hämopoetischer Stammzell-Transplantation wurde bei Dialysepatienten mit Niereninsuffizienz im Endstadium mit Erfolg angewandt. Einzelheiten sind der spezifischen Fachliteratur zu entnehmen.Anweisung für die parenterale ApplikationNach erfolgter Auflösung der Alkeran-Trockensubstanz kann die Verabreichung der Lösung als intravenöse Injektion oder Infusion sowie mittels regionalem Perfusionsverfahren erfolgen (siehe «Sonstige Hinweise»/«Hinweise für die Handhabung»).KontraindikationenAlkeran sollte nicht an Patienten mit bekannter Überempfindlichkeit gegenüber Melphalan oder einem der Hilfsstoffe verabreicht werden.Warnhinweise und VorsichtsmassnahmenAlkeran sollte nur von einem in der zytostatischen Therapie erfahrenen Arzt angewendet werden.Bei Extravasaten mit Alkeran i.v. kann lokal eine Weichteilläsion auftreten; daher sollte die Injektion nicht direkt in eine periphere Vene erfolgen. Es wird empfohlen, die Alkeran-Lösung in den Schlauch einer schnell fliessenden Infusion zu injizieren oder verdünnt in NaCl 0,9% zu verabreichen. Bei schlechten peripheren Venen sollte eventuell ein Zentral-Venenkatheter verwendet werden.Die Applikation von hochdosiertem Alkeran sollte in Anbetracht der möglichen Risiken und der erforderlichen Pflege nur durch Spezialisten und in einem spezialisierten Zentrum verwendet werden. Patienten mit hochdosiertem Alkeran müssen eventuell gegen Infekte prophylaktisch abgeschirmt und mit Blutprodukten substituiert werden.Bevor hochdosiertes Alkeran i.v. verwendet wird, sollten der Allgemeinzustand und die Organfunktion berücksichtigt werden.Alkeran ist eine stark myelosuppressive Substanz. Daher muss während und nach der Therapie mit Alkeran eine sorgfältige Überwachung des Blutbildes erfolgen, um eine exzessive Knochenmarksdepression und das Risiko einer irreversiblen Knochenmarksaplasie zu vermeiden.Da die Blutbildwerte auch nach Beendigung der Alkeran-Gabe noch weiter absinken können, sollte die Therapie bereits beim ersten Anzeichen eines anormal starken Abfalls der Leukozyten- oder Thrombozytenzahl unterbrochen werden.Bei Patienten mit vorangegangener Strahlen- oder Chemotherapie darf Alkeran im Hinblick auf die erhöhte Knochenmarkstoxizität nur mit besonderer Vorsicht eingesetzt werden.Bei der peroralen Einnahme ist die Absorption von Alkeran sehr variabel, daher kann es nötig sein, die Dosis vorsichtig anzupassen bis zur Myelosuppression, um sicher zu sein, dass die therapeutische Plasmakonzentration erreicht ist.Während einer Therapie mit Alkeran durchgeführte Impfungen können aufgrund der Immunsuppression wirkungslos sein. Impfungen mit Lebendimpfstoffen werden wegen der Gefahr einer Infektion nicht empfohlen.KarzinogenitätWie andere alkylierende Substanzen ist Melphalan beim Menschen leukämogen. Nach längerer Alkeran-Behandlung wurden akute Leukämien beschrieben: bei malignem Melanom, multiplem Myelom und Ovarialkarzinom. Ein Vergleich mit oder ohne Alkylanzien-Therapie – einschliesslich Melphalan – beim Ovarialkarzinom zeigte, dass als Folge der Therapie die Inzidenz akuter Leukämien signifikant erhöht ist. Daher sollte vor der Anwendung von Melphalan das leukämogene Risiko dem potentiellen therapeutischen Nutzen gegenübergestellt werden.Patienten mit NierenschädenDie Alkeran-Clearance kann bei Patienten mit Niereninsuffizienz, die auch eine urämische Knochenmarkssuppression haben können, reduziert sein. Eine Dosisreduktion kann daher nötig sein und diese Patienten müssen engmaschig kontrolliert werden (siehe auch «Dosierung bei Niereninsuffizienz»).Warnhinweise und VorsichtsmassnahmenAlkeran sollte nur von einem in der zytostatischen Therapie erfahrenen Arzt angewendet werden.Bei Extravasaten mit Alkeran i.v. kann lokal eine Weichteilläsion auftreten; daher sollte die Injektion nicht direkt in eine periphere Vene erfolgen. Es wird empfohlen, die Alkeran-Lösung in den Schlauch einer schnell fliessenden Infusion zu injizieren oder verdünnt in NaCl 0,9% zu verabreichen. Bei schlechten peripheren Venen sollte eventuell ein Zentral-Venenkatheter verwendet werden.Die Applikation von hochdosiertem Alkeran sollte in Anbetracht der möglichen Risiken und der erforderlichen Pflege nur durch Spezialisten und in einem spezialisierten Zentrum verwendet werden. Patienten mit hochdosiertem Alkeran müssen eventuell gegen Infekte prophylaktisch abgeschirmt und mit Blutprodukten substituiert werden.Bevor hochdosiertes Alkeran i.v. verwendet wird, sollten der Allgemeinzustand und die Organfunktion berücksichtigt werden.Alkeran ist eine stark myelosuppressive Substanz. Daher muss während und nach der Therapie mit Alkeran eine sorgfältige Überwachung des Blutbildes erfolgen, um eine exzessive Knochenmarksdepression und das Risiko einer irreversiblen Knochenmarksaplasie zu vermeiden.Da die Blutbildwerte auch nach Beendigung der Alkeran-Gabe noch weiter absinken können, sollte die Therapie bereits beim ersten Anzeichen eines anormal starken Abfalls der Leukozyten- oder Thrombozytenzahl unterbrochen werden.Bei Patienten mit vorangegangener Strahlen- oder Chemotherapie darf Alkeran im Hinblick auf die erhöhte Knochenmarkstoxizität nur mit besonderer Vorsicht eingesetzt werden.Bei der peroralen Einnahme ist die Absorption von Alkeran sehr variabel, daher kann es nötig sein, die Dosis vorsichtig anzupassen bis zur Myelosuppression, um sicher zu sein, dass die therapeutische Plasmakonzentration erreicht ist.Während einer Therapie mit Alkeran durchgeführte Impfungen können aufgrund der Immunsuppression wirkungslos sein. Impfungen mit Lebendimpfstoffen werden wegen der Gefahr einer Infektion nicht empfohlen.KarzinogenitätWie andere alkylierende Substanzen ist Melphalan beim Menschen leukämogen. Nach längerer Alkeran-Behandlung wurden akute Leukämien beschrieben: bei malignem Melanom, multiplem Myelom und Ovarialkarzinom. Ein Vergleich mit oder ohne Alkylanzien-Therapie – einschliesslich Melphalan – beim Ovarialkarzinom zeigte, dass als Folge der Therapie die Inzidenz akuter Leukämien signifikant erhöht ist. Daher sollte vor der Anwendung von Melphalan das leukämogene Risiko dem potentiellen therapeutischen Nutzen gegenübergestellt werden.Patienten mit NierenschädenDie Alkeran-Clearance kann bei Patienten mit Niereninsuffizienz, die auch eine urämische Knochenmarkssuppression haben können, reduziert sein. Eine Dosisreduktion kann daher nötig sein und diese Patienten müssen engmaschig kontrolliert werden (siehe auch «Dosierung bei Niereninsuffizienz»).InteraktionenDie gleichzeitige Anwendung von Nalidixinsäure mit hochdosiertem, intravenösem Alkeran hat bei Kindern zu hämorrhagischer Enterokolitis mit letalem Ausgang geführt.Nach Knochenmarkstransplantationen bei Patienten, die mit hochdosiertem Alkeran vorbehandelt wurden, ist Nierenversagen beobachtet worden, wenn Ciclosporin zur Verhütung der «graft versus host» Reaktion gegeben wurde.Schwangerschaft/StillzeitTeratogenität: Aufgrund der Ergebnisse einer alten Studie an Ratten sowie der Ähnlichkeit mit anderen alkylierenden Substanzen mit teratogenem Potential ist das Risiko von Missbildungen nicht auszuschliessen.Die Anwendung von Melphalan sollte wenn möglich während der Schwangerschaft vermieden werden, besonders während des ersten Trimenon. Bei jedem Fall muss individuell das potentielle Risiko für den Fötus gegenüber dem zu erwartenden Nutzen für die Mutter abgewogen werden.Wie bei jeder zytotoxischen Chemotherapie werden kontrazeptive Massnahmen empfohlen, wenn einer der Partner mit Alkeran behandelt wird.Während der Therapie mit Alkeran sollte nicht gestillt werden.Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Aufgrund der unerwünschten Wirkungen wie Übelkeit und Erbrechen ist beim Lenken von Fahrzeugen und Bedienen von Maschinen Vorsicht geboten.Unerwünschte WirkungenDie Inzidenz der unerwünschten Wirkungen hängt von der Indikation, der gewählten Dosierung und der Komedikation ab.Die beobachteten unerwünschten Wirkungen wurden anhand ihrer Häufigkeit wie folgt klassifiziert: Sehr häufig (>1/10), häufig (>1/100, <1/10), gelegentlich (>1/1'000, <1/100), selten (>1/10'000, <1/1'000), sehr selten (<1/10'000).Blut- und LymphsystemSehr häufig: Leukopenie, Thrombozytopenie und Anämie.Selten: Hämolytische Anämie.ImmunsystemGelegentlich: Allergische Reaktionen (siehe auch «Haut und Unterhautzellgewebe») mit Symptomen wie Urtikaria, Ödemen, Hautexanthemen und anaphylaktischem Schock nach Verabreichung von Initial- oder Erhaltungsdosis, insbesondere nach intravenöser Applikation.Selten wurde in diesem Zusammenhang auch von einem Herzstillstand berichtet.AtmungsorganeSelten: Interstitielle Pneumonie und Lungenfibrose (einschliesslich tödlich verlaufende Fälle).Gastrointestinale StörungenSehr häufig: Übelkeit und Erbrechen (je 30% bei konventioneller Dosis), Durchfall, Stomatitis bei hoher Dosierung.Selten: Stomatitis bei konventioneller Dosierung.Bei Patienten, die hochdosiert Alkeran in Verbindung mit einer autologen Knochenmarkstransplantation erhalten, ist die erhöhte Inzidenz von Diarrhö, Erbrechen und Stomatitis der Dosis limitierende Faktor. Eine Vorbehandlung mit Cyclophosphamid kann die gastrointestinalen Störungen bei hochdosiertem Alkeran mildern (Details sind der Literatur zu entnehmen).Leber und GalleSelten: Leberfunktionsstörungen verschiedenster Natur von abnormen Werten bei Leberfunktionstests bis zu klinischen Manifestationen wie Hepatitis und Ikterus; Lebervenenverschlusskrankheit (VOD) unter hohen parenteralen Dosen.Haut und UnterhautzellgewebeSehr häufig: Alopezie bei hoher Dosierung.Häufig: Alopezie bei konventioneller Dosierung.Selten: Makulopapulöses Exanthem, Pruritus (siehe «Immunsystem»).Muskel- und SkelettsystemBei regionaler arterieller PerfusionSehr häufig: Muskelatrophie, Muskelfibrose, Myalgie, erhöhte Kreatin-Phosphokinase im Blut.Häufig: Kompartementsyndrom.Muskelnekrose, Rhabdomyolyse.Nieren und HarnwegeHäufig: Vorübergehender signifikanter Anstieg der Harnstoff-Werte im Blut zu Beginn einer Melphalan-Therapie bei Myelom-Patienten mit vorbestehendem Nierenschaden.Reproduktionssystem und BrustHemmung der Ovarialfunktion, was bei der Mehrzahl der in der Prämenopause behandelten Patientinnen zu einer Amenorrhö führt.Vorübergehende oder dauernde Sterilität bei männlichen Patienten.Reaktionen an der ApplikationsstelleSehr häufig: Subjektives und vorübergehendes Wärmegefühl und/oder leichtes Brennen an der Injektionsstelle (66%).ÜberdosierungZeichen einer akuten Überdosierung sindNach oraler Überdosierung treten gastrointestinale Nebenwirkungen auf, wie Nausea, Erbrechen und Diarrhö. Die unmittelbaren Nebenwirkungen einer akuten intravenösen Überdosierung sind Nausea und Erbrechen. Es kann auch zu einer gastrointestinalen Mucosa-Schädigung kommen und zu einer manchmal hämorrhagischen Diarrhö. Die Hauptnebenwirkung ist jedoch eine Knochenmark-Suppression, die zu Leukopenie, Thrombozytopenie und Anämie führt.Behandlung der akuten ÜberdosierungUnterstützende Allgemeinmassnahmen und wenn nötig Blut- und Thrombozyten-Transfusionen sind einzuleiten. Es sollen weiter eine Hospitalisation, Antibiotika-Schutz und die Anwendung hämatologischer Wachstumsfaktoren in Erwägung gezogen werden.Ein spezifisches Antidot gibt es nicht. Bis zur Erholung sollte das Blutbild sorgfältig kontrolliert werden.Eigenschaften/WirkungenATC-Code: L01AA03Melphalan ist ein Stickstoff-Lost Derivat und gehört zu den bifunktionellen Alkylantien. Durch Aktivierung der beiden 2-Chloroäthylgruppen kommt eine kovalente Bindung zwischen N7 des DNS-Guanins zustande. Die Vernetzung zweier DNS-Stränge blockiert die Zellreplikation.PharmakokinetikAbsorptionDie orale Absorption von Melphalan ist individuell sehr verschieden. Die absolute Bioverfügbarkeit beträgt zwischen 56 und 85%. Die maximale Plasmakonzentration wird innerhalb von 0,5–2 Stunden erreicht. Wird Alkeran unmittelbar nach einer Mahlzeit verabreicht, verlängert sich die Zeit bis zum Erreichen der maximalen Plasmakonzentration und die Fläche unter der Konzentrationszeitkurve (AUC) wird um 39–45% reduziert.DistributionDas mittlere Verteilungsvolumen im Steady-State schwankt erheblich je nach Dosierung und beträgt ca. 40 ± 18 l. Der Übertritt in den Liquor ist gering. Die Bindung an Plasmaproteine beträgt 69–78% und erfolgt hauptsächlich an Albumin (55–60%) und weniger an α1-saures Glykoprotein (20%). Ca. 30% der Substanz ist irreversibel an Plasmaproteine gebunden (Alkylierung) bei Standarddosierung ist die Plasmaproteinbindung konzentrationsunabhängig. Bei Hochdosistherapie kann sie konzentrationsabhängigkeit sein. Es ist nicht bekannt, ob Melphalan plazentagängig ist oder ob es in die Muttermilch übertritt.MetabolismusNach Injektion von Melphalan wurden Monohydroxymelphalan und Dihydroxymelphalan im Plasma der Patienten nachgewiesen. Die maximale Plasmakonzentration dieser Metaboliten wurde nach 60 bzw. 105 min erreicht.Eine ähnliche Halbwertszeit (siehe «Elimination») wurde beobachtet, wenn Melphalan dem Patienten-Serum in vitro (bei 37 °C) zugegeben wurde, was darauf hinweist, dass der wichtigste Faktor der Halbwertszeit beim Menschen eher der spontane Abbau als der enzymatische Metabolismus ist.EliminationDie mittlere terminale Plasmahalbwertszeit nach oraler Gabe von 0,6 mg/kg KG Melphalan betrug 90 ± 57 min. 11% der Substanz wurden innerhalb von 24 h unverändert im Urin nachgewiesen. Nach oraler Verabreichung von 0,2–0,25 mg/kg KG betrug die mittlere Eliminationshalbwertszeit 1,12 ± 0,15 h.Die Pharmakokinetik von Melphalan i.v. nach konventionellen und nach hohen Dosen wird am besten durch ein bi-exponentielles 2-Kompartiment-Modell beschrieben.Nach einer hyperthermen Perfusion (39 °C) und nach einer Dosierung von 1,75 mg/kg betrug die mittlere initiale Halbwertszeit 3,6±1,5 min bzw. die terminale Halbwertszeit 46,5 ± 17,2 min.In verschiedenen Studien sind die Werte der Clearance unterschiedlich, entsprechend der Höhe der Dosierung. Bei hochdosierten i.v. Applikationen von 140 mg/m² war die mittlere Clearance 564±159 ml/min. Der Q0-Wert wird mit 0,9 angegeben.Kinetik spezieller PatientengruppenDie Kinetik bei älteren Patienten und konventioneller Dosierung ist unverändert, bei hohen Alkeran Dosen i.v. liegen bisher keine Daten vor.Bei Niereninsuffizienz kann die Melphalan-Clearance erniedrigt sein.Präklinische DatenMutagenitätAlkeran ist im Tierversuch mutagen. Bei behandelten Patienten wurden Chromosomen-Aberrationen beobachtet.KarzinogenitätMelphalan wurde in Karzinogenitätstests an Ratten und Mäusen bei intraperitonealer Injektion geprüft. In Ratten induzierte die Behandlung peritoneale Sarkome und in Mäusen führte sie zu Lymphosarkomen und dosisabhängig erhöhten Inzidenzen von Lungentumoren.TeratogenitätIn einer alten Studie an Ratten führte die Behandlung mit Melphalan zu einer erhöhten Inzidenz von Missbildungen.Sonstige HinweiseInkompatibilitätenDas Lyophilisat darf nur mit dem beigepackten Lösungsmittel aufgelöst und die rekonstituierte Lösung nur mit dem unter «Hinweise für die Handhabung» genannten Arzneimittel gemischt werden.Haltbarkeit/Besondere LagerungshinweiseFilmtabletten: Im Kühlschrank (2–8 °C) lagern.Injektions-/Infusionspräparat (Lyophilisat und Lösungsmittel): Nicht über 30 °C und vor Licht geschützt in der Originalpackung lagern. Nicht im Kühlschrank lagern, sonst kann es bei der Zubereitung der Infusionslösung zur Ausflockung von Melphalan kommen.Die Lösungen (unverdünnt und verdünnt) haben eine beschränkte Stabilität und sollten daher unmittelbar vor Verwendung hergestellt werden. Zwischen der Zubereitung der verdünnten Infusionslösung und dem Infusionsende sollte eine Zeitspanne von 1½ Stunden nicht überschritten werden. Nicht verwendete Lösungen sollen entsorgt werden.Die Arzneimittel dürfen nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.Hinweise für die HandhabungHerstellung der Alkeran-InjektionslösungDie Herstellung der Alkeran-Injektionslösung erfolgt bei Raumtemperatur. Das Lyophilisat wird mit dem Lösungsmittel aufgelöst. Es werden 10 ml Lösungsmittel in einer Portion zur Trockensubstanz gegeben und sofort kräftig geschüttelt, bis diese vollständig gelöst ist. Die so hergestellte Lösung enthält 5 mg/ml Melphalan und hat einen pH-Wert von ca. 6,5. Die Lösung hat eine beschränkte Stabilität und sollte daher unmittelbar vor Verwendung hergestellt werden. Nicht verwendete Lösung soll entsorgt werden. Die hergestellte Lösung sollte nicht gekühlt werden, da sonst Ausflockungen entstehen.Intravenöse Anwendung i.v.Ausgenommen in Fällen, wo eine regionale arterielle Perfusion indiziert ist, wird Alkeran nur intravenös verwendet. Es ist empfehlenswert, Alkeran i.v. langsam in den Schlauch einer rasch fliessenden i.v. Infusion zu injizieren. Ist dies nicht möglich, ist Alkeran in eine i.v. Infusion zu geben. Die rekonstituierte Lösung sollte mit einer NaCl 0,9%-Infusionslösung verdünnt werden, so dass die Melphalan-Konzentration 0,45 mg/ml nicht übersteigt. Als Infusionslösung sollte nur NaCl 0,9% verwendet werden, keine Glukose-Infusion. Wird Alkeran mit einer Infusionslösung weiter verdünnt, nimmt die Stabilität ab und die Degradation mit zunehmender Temperatur rasch zu. Wird Alkeran bei Raumtemperatur (ca. 25 °C) infundiert, sollte die Zeitspanne zwischen der Vorbereitung bis zum Infusionsende 1½ Stunden nicht überschreiten.Tritt eine sichtbare Trübung oder Ausflockung nach Auflösen oder Verdünnen von Alkeran i.v. auf, ist die Lösung nicht zu verwenden. Die Lösung sollte streng i.v. appliziert werden, Extravasate sind zu vermeiden. Bei schlechten peripheren Venen sollte eventuell ein Zentral-Venenkatheter verwendet werden. Bei hochdosierter i.v.-Applikation mit oder ohne autologer Knochenmarkstransplantation ist ein Zentral-Venenkatheter empfehlenswert.Regionale arterielle PerfusionZum Verfahren der regionalen arteriellen Perfusion ist die Literatur zu konsultieren.Sichere Handhabung von AlkeranBei der Handhabung von Alkeran, der Zubereitung der Injektions-/Infusionslösung und der Entsorgung sind die Richtlinien für Zytostatika zu befolgen (für Filmtabletten siehe auch «Dosierung/Anwendung»).Zulassungsnummer30897, 52193 (Swissmedic).ZulassungsinhaberinAspen Pharma Schweiz GmbH, Baar.
用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 马法兰冻干粉注射剂Alkeran Trockensubstanz 50mg
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 马法兰冻干粉注射剂Alkeran Trockensubstanz 50mg