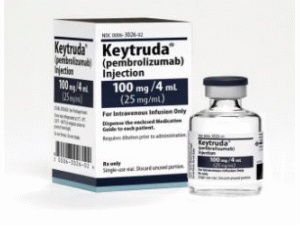
派姆单抗,派姆单抗冻干粉注射剂(Keytruda Infusionskonzentrat 100mg/4ml)
 药店国别:无
产地国家:瑞士
处方药:是
所属类别: 100毫克/4毫升/瓶
包装规格: 100毫克/4毫升/瓶
计价单位:瓶
生产厂家中文参考译名:无
生产厂家英文名:MSD Merck Sharp & Dohme AG
原产地英文商品名:Keytruda Infusionskonzentrat 100mg/4ml Durchstechflasche
原产地英文药品名:pembrolizumab
中文参考商品译名:Keytruda冻干粉注射剂 100毫克/4毫升/瓶
中文参考药品译名:派姆单抗
曾用名:无
药店国别:无
产地国家:瑞士
处方药:是
所属类别: 100毫克/4毫升/瓶
包装规格: 100毫克/4毫升/瓶
计价单位:瓶
生产厂家中文参考译名:无
生产厂家英文名:MSD Merck Sharp & Dohme AG
原产地英文商品名:Keytruda Infusionskonzentrat 100mg/4ml Durchstechflasche
原产地英文药品名:pembrolizumab
中文参考商品译名:Keytruda冻干粉注射剂 100毫克/4毫升/瓶
中文参考药品译名:派姆单抗
曾用名:无
简介
部份中文派姆单抗处方资料(仅供参考) 英文名:pembrolizumab 商品名:Keytruda 中文名:派姆单抗注射剂 生产商:默沙东 药品介绍 Keytruda(pembrolizumab)由默沙东(Merck & Co)公司研制,于2014年被美国食品药品监督管理局 (FDA)及欧盟 授权批准治疗对其它不再反应的晚期或不可切除黑色素瘤及其他的癌症。 Keytruda是在美国及欧盟第一个被批准的阻断被称为PD-1的细胞通路的药物。 靶点:PD-1 主要成分 pembrolizumab作用机制PD-1配体,PD-L1和PD-L2,与T细胞上发现的PD-1受体的结合,抑制T细胞增殖和细胞因子的产生。在某些肿瘤中发生PD-1配体的上调和通过这个途径信号对肿瘤活性的T-细胞免疫监视抑制作用可能有贡献。Pembrolizumab是一个单克隆抗体结合至PD-1受体和阻断其与PD-L1和PD-L2相互作用,释放免疫反应的PD-1通路-介导抑制作用,包括抗-肿瘤免疫反应。 在同基因小鼠肿瘤模型中,阻断PD-1活性导致肿瘤生长的减低。 用法用量 ⑴ 每3周给予2 mg/kg作为历时30分钟静脉输注。 ⑵ 静脉输注前重建和稀释。 剂型和规格 ⑴ 为注射:50mg为重建在一次性使用小瓶中冰冻干燥粉。 ⑵ 注射用: 100mg/4mL(25 mg/mL)溶液在一次性使用小瓶。 适应症 黑色素瘤、非小细胞肺癌、肾癌、霍奇金淋巴瘤、头颈部鳞状细胞癌、膀胱癌(尿路上皮癌)其他肿瘤、对于肝癌、小细胞肺癌、胰腺癌、胃癌、结直肠癌等疗效:临床试验阶段,对这类实体瘤也有一定疗效。这些实体瘤的应答率较低,在30%左右,疾病控制率在40-50%左右 不良反应 最常见不良反应(报告在≥20%患者)有: (1)黑色素瘤包括疲劳,咳嗽,恶心,瘙痒,皮疹,食欲减低, 便秘,关节痛,和腹泻。 (2)NSCLC 包括疲乏,食欲减退,呼吸困难和咳嗽。 注意事项 (1)免疫-介导肺炎:对中度不给,和永远终止对严重,危及生命或复发中度肺炎。 (2)免疫-介导结肠炎:对中度或严重不给,和对危及生命结肠炎永远终止。 (3)免疫-介导肝炎: 监视肝功能中变化。根据肝酶升高严重程度,不给或终止。 (4)免疫-介导内分泌病:1.垂体炎:对中度不给和对严重或危及生命垂体炎不给或永久终止。 2.甲状腺疾病: 监视甲状腺功能。对严重或危及生命甲状腺功能亢进不给或永远终止。 3.1型糖尿病: 监视高血糖。在严重高血糖病例不给 KEYTRUDA。 (5)免疫-介导肾炎: 监视肾功能变化。对中度不给,和对严重或危及生命肾炎永远终止。 (6)输注-相关反应: 停止输注和对严重或危及生命 输注反应永远终止KEYTRUDA。 (7)胚胎胎儿毒性: KEYTRUDA可致胎儿危害。忠告生殖潜能女性对胎儿潜在风险。 禁忌:无 药理毒性 PD-1配体,PD-L1和PD-L2,与T细胞上发现的PD-1受体的结合,抑制T细胞增殖和细胞因子的产生。在某些肿瘤中发生PD-1配体的上调和通过这个途径信号对肿瘤活性的T-细胞免疫监视抑制作用可能有贡献。 Pembrolizumab是一个单克隆抗体结合至PD-1受体和阻断其与PD-L1和PD-L2相互作用,释放免疫反应的PD-1通路-介导抑制作用,包括抗-肿瘤免疫反应。在同基因小鼠肿瘤模型中,阻断PD-1活性导致肿瘤生长的减低。药物过量没有用KEYTRUDA药物过量的资料。 孕妇及哺乳用药哺乳母亲:终止哺乳或终止KEYTRUDA。英文版说明
Keytruda Infusionskonzentrat 100mg/4ml DurchstechflascheFachinformationenZusammensetzungWirkstoff: Pembrolizumab.Hilfsstoffe: L-Histidin, L-Histidinhydrochlorid-Monohydrat, Saccharose, Polysorbat 80 (aus gentechnisch verändertem Mais hergestellt), Wasser für Injektionszwecke.Galenische Form und Wirkstoffmenge pro EinheitKonzentrat zur Herstellung einer Infusionslösung:Klare bis leicht opaleszierende, farblose bis blassgelbe Lösung.Jeder ml des Konzentrats enthält 25 mg Pembrolizumab.Jede Durchstechflasche mit 4 ml enthält 100 mg Pembrolizumab mit einem kalkulierten Füllmengenüberschuss von 0,25 ml (Gesamtinhalt je Durchstechflasche: 4,25 ml).Indikationen/AnwendungsmöglichkeitenMelanomKeytruda kann angewendet werden bei nicht resezierbarem oder metastasiertem Melanom bei Erwachsenen.Keytruda ist als Monotherapie indiziert zur adjuvanten Behandlung von Erwachsenen mit vollständig reseziertem Melanom Stadium III (siehe «Klinische Wirksamkeit»).Nicht-kleinzelliges LungenkarzinomKeytruda ist als Monotherapie indiziert zur Erstlinienbehandlung des metastasierten nicht-kleinzelligen Lungenkarzinoms (NSCLC) bei Erwachsenen, deren Tumore PD-L1 mit einem Tumour proportion score (TPS) ≥50% exprimieren und keine genomischen Tumoraberrationen vom EGFR oder ALK Typ haben.Keytruda in Kombination mit Pemetrexed und Platin-Chemotherapie ist indiziert zur Erstlinienbehandlung des metastasierten nicht-plattenepithelialen NSCLC bei Erwachsenen, die keine genomischen Tumoraberrationen vom EGFR oder ALK Typ haben.Keytruda ist als Monotherapie indiziert zur Behandlung des fortgeschrittenen, metastasierten NSCLC nach vorangegangener Chemotherapie bei Erwachsenen, deren Tumore PD-L1 mit einem TPS ≥1% exprimieren. Patienten mit genomischen Tumoraberrationen vom EGFR oder ALK Typ sollten zudem eine für diese Aberrationen zugelassene Therapie erhalten haben, bevor sie mit Keytruda behandelt werden.Klassisches Hodgkin LymphomKeytruda ist indiziert zur Behandlung des refraktären oder rezidivierenden klassischen Hodgkin Lymphoms (rrcHL) bei Erwachsenen mit mindestens 3 Vorbehandlungen.UrothelkarzinomKeytruda ist indiziert zur Behandlung des lokal fortgeschrittenen oder metastasierten Urothelkarzinoms bei Erwachsenen, die mit platin-basierter Chemotherapie vorbehandelt wurden.Dosierung/AnwendungDie Behandlung muss von einem in der Krebstherapie erfahrenen Arzt eingeleitet und überwacht werden. Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.PD-L1 Test für Patienten mit NSCLC, die mit Keytruda als Monotherapie behandelt werden sollenFür die Behandlung von NSCLC mit Keytruda sollten die Patienten eine positive PD-L1 Expression aufweisen, die durch einen für Keytruda validierten Test bestätigt wurde (siehe Rubrik «Eigenschaften/Wirkungen»).DosierungDie empfohlene Dosis Keytruda beträgt 200 mg alle 3 Wochen als 30 minütige intravenöse Infusion verabreicht.Wenn Keytruda als Teil einer Kombinationsbehandlung mit Pemetrexed und Platin-Chemotherapie angewendet wird, sollte Keytruda zuerst verabreicht werden. Siehe auch Fachinformation zu Pemetrexed und der gewählten Platin-Chemotherapie.Die Behandlung mit Keytruda ist bis zur Krankheitsprogression bzw. bis zum Auftreten unzumutbarer Toxizitätserscheinungen fortzusetzen.Zur adjuvanten Behandlung des Melanoms sollte Keytruda bis zur Krankheitsprogression oder bis zum Auftreten unzumutbarer Toxizität, für maximal 12 Monate verabreicht werden.Art der AnwendungHinweise zur Verdünnung des Konzentrats vor der Anwendung siehe Rubrik «Sonstige Hinweise».Bei cHL-Patienten mit Grad 4 hämatologischer Toxizität ist die Behandlung mit Keytruda auszusetzen bis die unerwünschten Wirkungen sich auf Grad 0-1 gebessert haben.Spezielle DosierungsempfehlungenÄltere PatientenInsgesamt wurden bezüglich der Sicherheit oder Wirksamkeit keine Unterschiede zwischen älteren Patienten (65 Jahre und älter) und jüngeren Patienten (unter 65 Jahren) berichtet. Bei dieser Patientengruppe ist keine Anpassung der Dosierung erforderlich.Verwendung von Pembrolizumab zur adjuvanten Behandlung von Patienten mit Melanom:Ein Trend zu einer erhöhten Häufigkeit schwerer und schwerwiegender unerwünschter Wirkungen bei Patienten ≥75 Jahren wurde beobachtet. Die Sicherheitsdaten zu Pembrolizumab im adjuvanten Melanom-Setting bei Patienten ≥75 Jahren sind begrenzt.NiereninsuffizienzBei Patienten mit leichter bis mässiger Niereninsuffizienz ist keine Dosisanpassung erforderlich. Bei Patienten mit schwerer Niereninsuffizienz wurde Keytruda nicht untersucht (siehe «Pharmakokinetik»).LeberinsuffizienzBei Patienten mit leichter Leberinsuffizienz ist keine Dosisanpassung erforderlich. Bei Patienten mit mässiger bis schwerer Leberinsuffizienz wurde Keytruda nicht untersucht (siehe «Pharmakokinetik»).Kinder und JugendlicheDie Sicherheit und Wirksamkeit von Keytruda bei Kindern und Jugendlichen unter 18 Jahren sind noch nicht belegt. Es sind keine Daten verfügbar.KontraindikationenSchwere Überempfindlichkeit gegenüber dem Wirkstoff oder einem der in der Rubrik «Zusammensetzung» genannten Hilfsstoffe.Warnhinweise und VorsichtsmassnahmenImmunvermittelte unerwünschte WirkungenBei Patienten unter Pembrolizumab traten immunvermittelte unerwünschte Wirkungen, einschliesslich schwerwiegende Fälle und solche mit tödlichem Ausgang auf. Immunvermittelte unerwünschte Wirkungen können auch nach Absetzen der Behandlung auftreten.In klinischen Studien waren die meisten immunvermittelten unerwünschten Wirkungen reversibel und durch Aussetzen von Pembrolizumab, Verabreichung von Kortikosteroiden und/oder unterstützende Massnahmen behandelbar. Immunvermittelte unerwünschte Wirkungen, die mehr als ein Organsystem betreffen, können gleichzeitig auftreten.Bei Verdacht auf immunvermittelte unerwünschte Wirkungen muss mittels adäquater Beurteilung die Ätiologie bestätigt oder andere Ursachen ausgeschlossen werden. In Abhängigkeit vom Schweregrad der unerwünschten Wirkung muss die Behandlung mit Pembrolizumab unterbrochen und eine Kortikosteroidtherapie in Betracht gezogen werden. Nach Erreichen einer Verbesserung auf Grad 1 oder weniger kann die Kortikosteroidbehandlung über einen Zeitraum von mindestens 1 Monat ausgeschlichen werden. Basierend auf limitierten Daten aus klinischen Studien mit Patienten, bei denen die immunvermittelten unerwünschten Wirkungen nicht mit Kortikosteroiden kontrolliert werden konnten, kann die Gabe von anderen systemischen Immunsuppressiva erwogen werden. Die Behandlung mit Pembrolizumab wird wieder aufgenommen, wenn die unerwünschte Wirkung nach Ausschleichen der Kortikosteroidbehandlung bei Schweregrad 1 oder weniger verbleibt. Beim Auftreten einer weiteren Episode einer schweren unerwünschten Wirkung ist Pembrolizumab definitiv abzusetzen (siehe Rubrik «Dosierung/Anwendung» und «Unerwünschte Wirkungen»).Immunvermittelte PneumonitisBei Patienten unter Pembrolizumab wurde das Auftreten von Pneumonitis, einschliesslich tödlicher Fälle, gemeldet (siehe «Unerwünschte Wirkungen»). Die Patienten müssen auf Symptome einer Pneumonitis überwacht werden. Bei Verdacht auf Pneumonitis ist eine Abklärung mittels radiographischer Verfahren erforderlich. Andere mögliche Ursachen müssen ausgeschlossen werden. Verabreichung von Kortikosteroiden bei Grad 2 oder höheren Ereignissen (Initialdosis von 1–2 mg/kg/Tag Prednison oder entsprechendes Wirkstoffäquivalent, gefolgt von einer Ausschleichphase) und Aussetzen von Pembrolizumab bei mässiger (Grad 2) Pneumonitis, definitives Absetzen von Pembrolizumab bei schwerer (Grad 3) oder lebensbedrohlicher (Grad 4) oder wiederkehrender mässiger (Grad 2) Pneumonitis (siehe «Dosierung/Anwendung» und «Immunvermittelte unerwünschte Wirkungen»).Immunvermittelte KolitisBei Patienten unter Pembrolizumab wurde das Auftreten von schwerer Diarrhö und Kolitis gemeldet (siehe «Dosierung/Anwendung»). Die Patienten müssen auf Symptome einer Kolitis, einschliesslich Diarrhö, überwacht werden und andere mögliche Ursachen müssen ausgeschlossen werden. Verabreichung von Kortikosteroiden bei Grad 2 oder höheren Ereignissen (Initialdosis von 1–2 mg/kg/Tag Prednison oder entsprechendes Wirkstoffäquivalent, gefolgt von einer Ausschleichphase), Aussetzen von Pembrolizumab bei mässiger (Grad 2) oder schwerer (Grad 3) Kolitis, definitives Absetzen von Pembrolizumab bei lebensbedrohlicher (Grad 4) Kolitis (siehe Rubrik «Dosierung/Anwendung» und «Immunvermittelte unerwünschte Wirkungen»).Immunvermittelte HepatitisBei Patienten unter Pembrolizumab wurde das Auftreten von Hepatitis gemeldet (siehe «Unerwünschte Wirkungen»). Die Patienten müssen auf Veränderungen der Leberfunktion (zu Behandlungsbeginn, regelmässig während der Behandlung sowie bei entsprechender klinischer Indikation) und Hepatitis-Symptome überwacht werden. Andere mögliche Ursachen müssen ausgeschlossen werden. Verabreichung von Kortikosteroiden (Initialdosis von 0,5-1 mg/kg/Tag (bei Grad 2 Ereignissen) und 1–2 mg/kg/Tag (bei Grad 3 oder höheren Ereignissen) Prednison oder entsprechendes Wirkstoffäquivalent, gefolgt von einer Ausschleichphase) sowie – in Abhängigkeit von der Grössenordnung der Leberenzymerhöhungen – Aus- oder Absetzen von Pembrolizumab (siehe Rubrik «Dosierung/Anwendung» und «Immunvermittelte unerwünschte Wirkungen»).Immunvermittelte NephritisBei Patienten unter Pembrolizumab wurde das Auftreten von Nephritis gemeldet (siehe «Unerwünschte Wirkungen»). Die Patienten müssen auf Veränderungen der Nierenfunktion überwacht werden und andere Ursachen der Nephritis müssen ausgeschlossen werden. Verabreichung von Kortikosteroiden bei Grad 2 oder höheren Ereignissen (Initialdosis von 1–2 mg/kg/Tag Prednison oder entsprechendes Wirkstoffäquivalent, gefolgt von einer Ausschleichphase), Aussetzen von Pembrolizumab bei mässiger (Grad 2) und endgültiges Absetzen von Pembrolizumab bei schwerer (Grad 3) oder lebensbedrohlicher (Grad 4) Nephritis (siehe Rubrik «Dosierung/Anwendung» und «Immunvermittelte unerwünschte Wirkungen»).Immunvermittelte EndokrinopathienBei Patienten unter Pembrolizumab wurde das Auftreten von Hypophysitis gemeldet (siehe «Unerwünschte Wirkungen»). Die Patienten müssen auf Symptome von Hypophysitis (einschliesslich Hypopituitarismus und sekundäre Nebenniereninsuffizienz) überwacht werden und andere Ursachen müssen ausgeschlossen werden. Verabreichung von Kortikosteroiden zur Behandlung der sekundären Nebenniereninsuffizienz, sowie Substitution anderer Hormone, falls klinisch indiziert. Aussetzen von Pembrolizumab bei mässiger (Grad 2) und Aussetzen oder endgültiges Absetzen von Pembrolizumab bei schwerer (Grad 3) oder lebensbedrohlicher (Grad 4) Hypophysitis (siehe Rubrik «Dosierung/Anwendung» und «Immunvermittelte unerwünschte Wirkungen»).Bei Patienten unter Pembrolizumab wurde das Auftreten von Typ-1-Diabetes mellitus, einschliesslich diabetischer Ketoazidose, gemeldet (siehe «Unerwünschte Wirkungen»). Die Patienten müssen auf Hyperglykämie oder andere Symptome von Diabetes überwacht werden. Verabreichung von Insulin bei Typ-1-Diabetes mellitus und Aussetzen von Pembrolizumab bei schwerer Hyperglykämie bis die metabolische Kontrolle erreicht ist.Bei Patienten unter Pembrolizumab wurde das Auftreten von Schilddrüsenfunktionsstörungen, einschliesslich Hyperthyreose, Hypothyreose und Thyroiditis gemeldet. Diese können jederzeit während der Behandlung auftreten, daher müssen die Patienten auf Veränderungen der Schilddrüsenfunktion (zu Behandlungsbeginn, regelmässig während der Behandlung sowie bei entsprechender klinischer Indikation) und klinische Symptome von Schilddrüsenfunktionsstörungen überwacht werden. Die Hypothyreose kann ohne Behandlungsunterbruch und ohne Kortikosteroide mittels einer Substitutionstherapie kontrolliert werden. Hyperthyreose kann symptomatisch behandelt werden. Aussetzen oder endgültiges Absetzen von Pembrolizumab bei schwerer (Grad 3) oder lebensbedrohlicher (Grad 4) Hyperthyreose (siehe Rubrik «Dosierung/Anwendung», «Unerwünschte Wirkungen» und «Immunvermittelte unerwünschte Wirkungen»).Bei Patienten mit schwerer (Grad 3) oder lebensbedrohlicher (Grad 4) Endokrinopathie, bei der eine Verbesserung auf Grad 2 oder tiefer erreicht wurde und die durch Hormonsubstitution unter Kontrolle ist, kann die Weiterführung der Pembrolizumab Behandlung in Erwägung gezogen werden.Schwere HautreaktionenBei Patienten unter Behandlung mit Keytruda wurden schwere immunvermittelte Hautreaktionen gemeldet. Patienten sind bezüglich vermuteter schwerer Hautreaktionen zu überwachen und andere Ursachen sind auszuschliessen. In Abhängigkeit vom Schweregrad der unerwünschten Wirkung ist die Behandlung mit Keytruda zu unterbrechen oder endgültig abzusetzen und eine Kortikosteroidtherapie einzuleiten (siehe «Dosierung/Anwendung»).Fälle mit Stevens-Johnson-Syndrom (SJS) und toxischer epidermaler Nekrolyse (TEN), davon einige mit tödlichem Ausgang, wurden bei Patienten unter Behandlung mit Keytruda gemeldet. Bei Anzeichen oder Symptomen von SJS oder TEN, ist die Behandlung mit Keytruda zu unterbrechen und der Patient in die spezialisierte Pflege zur Beurteilung und Behandlung zu überweisen. Sollten sich SJS oder TEN bestätigen, ist Keytruda endgültig abzusetzen (siehe «Dosierung/Anwendung»).Andere immunvermittelte unerwünschte WirkungenDie folgenden zusätzlichen klinisch relevanten, immunvermittelten unerwünschten Wirkungen wurden bei Patienten berichtet, die Pembrolizumab erhielten: Uveitis, Myositis, Myokarditis, Guillain-Barré-Syndrom, Pankreatitis, Enzephalitis, Sarkoidose und Myasthenie-Syndrom/Myasthenia gravis (einschliesslich Exzerbation) (siehe «Dosierung/Anwendung» und «Unerwünschte Wirkungen»).Fälle dieser immunvermittelten unerwünschten Wirkungen, von denen einige schwerwiegend oder tödlich waren, wurden im Rahmen klinischer Studien oder nach Markteinführung berichtet.Seltene Fälle von Myotoxizität (z.B. Myositis; einschliesslich tödlicher Verläufe) wurden unter Pembrolizumab berichtet. Wenn ein Patient Anzeichen und Symptome einer Myotoxizität entwickelt, sollte eine engmaschige Überwachung durchgeführt werden und der Patient unverzüglich an eine spezialisierte Abteilung zur Beurteilung und Behandlung überwiesen werden. Basierend auf dem Schweregrad der Myotoxizität sollte Pembrolizumab aufgeschoben oder abgesetzt (siehe Tabelle 1 unter «Dosierung/Anwendung») und eine geeignete Behandlung eingeleitet werden.Aufgrund des Schweregrads der unerwünschten Wirkungen sollte Pembrolizumab ausgesetzt oder abgesetzt und/oder Kortikosteroide verabreicht werden (siehe «Dosierung/Anwendung» und «Unerwünschte Wirkungen»).Unerwünschte Wirkungen bei TransplantationspatientenIm Post-Marketing Setting wurde über Abstossung von Organtransplantaten bei Patienten unter Behandlung mit Keytruda berichtet. Die Behandlung mit Keytruda kann möglicherweise das Risiko einer Abstossung bei Empfängern von Organtransplantaten erhöhen. Der Nutzen der Behandlung mit Keytruda ist gegenüber dem Risiko einer möglichen Organabstossung bei diesen Patienten zu berücksichtigen.Allogene hämatopoetische Stammzelltransplantation (HSZT) nach Behandlung mit KeytrudaFälle von Graft-versus-Host-Disease (GvHD) und Lebervenenverschlusskrankheit (VOD) wurden bei Patienten mit klassischem Hodgkin Lymphom beobachtet, die sich nach einer vorangegangenen Therapie mit Keytruda einer allogenen HSZT unterzogen. Bis weitere Daten zur Verfügung stehen, sollten der potenzielle Nutzen einer HSZT und das möglicherweise erhöhte Risiko transplantationsbedingter Komplikationen von Fall zu Fall sorgfältig gegeneinander abgewogen werden.Allogene HSZT vor Behandlung mit KeytrudaBei Patienten mit einer Vorgeschichte einer allogenen HSZT wurde über eine akute GvHD, einschliesslich GvHD mit tödlichem Ausgang, nach Behandlung mit Keytruda berichtet. Patienten, die eine GvHD nach ihrer Transplantation hatten, weisen möglicherweise ein erhöhtes Risiko für eine weitere GvHD Episode nach der Behandlung mit Keytruda auf. Der Nutzen einer Behandlung mit Keytruda ist gegenüber dem Risiko einer möglichen GvHD bei Patienten mit einer Vorgeschichte einer allogenen HSZT abzuwägen.Erhöhte Mortalität bei Patienten mit multiplem Myelom bei Gabe von Keytruda zusätzlich zu einem Thalidomid-Analogon und DexamethasonIn zwei randomisierten klinischen Studien bei Patienten mit multiplem Myelom führte die Gabe von Keytruda zusätzlich zu einem Thalidomid-Analogon plus Dexamethason, einer Anwendung für die kein PD-1 oder PD-L1 blockierender Antikörper indiziert ist, zu einer erhöhten Mortalität. Die Behandlung von Patienten mit multiplem Myelom mit einem PD-1 oder PD-L1 blockierenden Antikörper in Kombination mit einem Thalidomid-Analogon plus Dexamethason wird ausserhalb kontrollierter klinischer Studien nicht empfohlen.Infusionsbedingte ReaktionenBei Patienten unter Pembrolizumab wurde das Auftreten von schweren infusionsbedingten Reaktionen, einschliesslich Überempfindlichkeit und Anaphylaxie, gemeldet (siehe «Unerwünschte Wirkungen»). Bei schweren infusionsbedingten Reaktionen ist die Infusion zu stoppen und die Behandlung mit Pembrolizumab ist endgültig abzusetzen (siehe «Dosierung/Anwendung»). Patienten mit schwachen oder mässigen Infusionsreaktionen können Pembrolizumab unter enger Überwachung weiterhin erhalten. Eine Prämedikation mit Antipyretika oder Antihistaminika kann in Betracht gezogen werden.Von klinischen Studien ausgeschlossene PatientenPatienten mit folgenden Erkrankungen waren von den klinischen Studien ausgeschlossen: aktiven ZNS-Metastasen; Patienten mit ECOG Performance Status ≥2 (ausser bei Urothelkarzinom); HIV-, Hepatitis-B- oder Hepatitis-C-Infektion; aktiver, systemischer Autoimmunerkrankung; interstitieller Lungenkrankheit; einer früheren Pneumonitis, die eine systemische Kortikosteroidbehandlung erforderte; einer schweren Überempfindlichkeit gegen einen anderen monoklonalen Antikörper in der Anamnese; laufender Therapie mit Immunsuppressiva sowie Patienten mit schweren immunvermittelten Nebenwirkungen unter Ipilimumab in der Anamnese, definiert als jegliche Grad 4 oder Grad 3 Toxizität, die eine Kortikosteroid-Behandlung über mehr als 12 Wochen erforderte (>10 mg/Tag Prednison oder eines Äquivalents). Patienten mit aktiven Infektionserkrankungen wurden von den klinischen Studien ausgeschlossen. Patienten mit klinisch relevanten Abweichungen der Nierenfunktion (Kreatinin >1,5 x ULN) oder Leberfunktion (Bilirubin >1,5× ULN, oder ALT, AST >2,5× ULN ohne Vorliegen von Lebermetastasen) vor Behandlungsbeginn waren von den klinischen Studien ausgeschlossen.InteraktionenEs wurden keine formalen pharmakokinetischen Interaktionsstudien mit Pembrolizumab durchgeführt. Da Pembrolizumab durch Katabolismus aus der Zirkulation entfernt wird, sind keine metabolischen Wechselwirkungen mit anderen Wirkstoffen zu erwarten.Die Verabreichung von systemischen Kortikosteroiden oder von Immunsuppressiva vor Beginn der Behandlung mit Pembrolizumab ist aufgrund der möglichen Beeinträchtigung der pharmakodynamischen Aktivität und Wirksamkeit von Pembrolizumab zu vermeiden. Jedoch können nach Einleitung der Behandlung mit Pembrolizumab systemische Kortikosteroide oder andere Immunsuppressiva zur Behandlung immunvermittelter unerwünschter Wirkungen eingesetzt werden (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).Schwangerschaft/StillzeitSchwangerschaftEs liegen keine Daten zur Anwendung von Pembrolizumab bei Schwangeren vor. Entsprechende tierexperimentelle Reproduktionsstudien mit Pembrolizumab wurden nicht durchgeführt; in murinen Schwangerschaftsmodellen wurde jedoch nachgewiesen, dass die Unterbrechung des PD-L1-Signalwegs die Toleranz gegenüber dem Fetus aufhebt und zu einer Zunahme von Aborten führt (siehe «Präklinische Daten»). Diese Ergebnisse deuten darauf hin, dass während der Schwangerschaft die Verabreichung von Pembrolizumab aufgrund seines Wirkmechanismus fetale Schäden hervorrufen und unter anderem zu vermehrten Fehl- oder Totgeburten führen könnte. Humanes IgG4 (Immunglobulin) ist bekanntermassen plazentagängig, und bei Pembrolizumab handelt es sich um ein IgG4; daher besteht die Möglichkeit, dass Pembrolizumab von der Mutter auf den sich entwickelnden Fetus übertragen werden kann. Während der Schwangerschaft darf Pembrolizumab nicht verabreicht werden, es sei denn die Behandlung mit Pembrolizumab ist aufgrund des klinischen Zustandes der Frau erforderlich.Gebärfähige Frauen sollten während der Behandlung mit Pembrolizumab und während mindestens 4 Monaten nach der letzten Pembrolizumab Dosis eine zuverlässige Verhütungsmethode anwenden.StillzeitEs ist nicht bekannt, ob Pembrolizumab in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, muss – unter Abwägung der Vorteile des Stillens für das Kind und des Nutzens der Behandlung mit Pembrolizumab für die Mutter – entweder abgestillt oder Keytruda abgesetzt werden (siehe «Präklinische Daten»).Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenPembrolizumab kann einen geringen Einfluss auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben. Aufgrund möglicher unerwünschter Wirkungen wie Müdigkeit (siehe Abschnitt «Unerwünschte Wirkungen»), sollten die Patienten angewiesen werden, beim Fahren oder Bedienen von Maschinen vorsichtig zu sein, bis sie sicher sind, dass Pembrolizumab ihre Fähigkeiten nicht beeinträchtigt.Unerwünschte WirkungenZusammenfassung des SicherheitsprofilsPembrolizumab ist am häufigsten mit immunvermittelten unerwünschten Wirkungen assoziiert. Die meisten dieser unerwünschten Wirkungen, einschliesslich schwerer Reaktionen, klangen nach Einleitung einer adäquaten medizinischen Behandlung oder nach Absetzen von Pembrolizumab ab (siehe «Unerwünschte Wirkungen, Immunvermittelte unerwünschte Wirkungen»). Die Häufigkeitsangaben der unerwünschten Wirkungen in Tabelle 2 sind möglicherweise nicht vollständig auf Pembrolizumab alleine zurückzuführen, sondern können allenfalls Mitwirkungen der zugrundeliegenden Erkrankung oder von anderen in einer Kombination verwendeten Arzneimitteln beinhalten.Die Sicherheit von Pembrolizumab als Monotherapie wurde bei 4948 Patienten mit fortgeschrittenem Melanom, reseziertem Melanom Stadium III (adjuvante Therapie), NSCLC, cHL oder Urothelkarzinom und in anderen klinischen Studien über vier Dosierungen (2 mg/kg alle 3 Wochen, 200 mg alle 3 Wochen, oder 10 mg/kg alle 2 oder 3 Wochen) eva luiert. In dies用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 派姆单抗,派姆单抗冻干粉注射剂(Keytruda Infusionskonzentrat 100mg/4ml)
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 派姆单抗,派姆单抗冻干粉注射剂(Keytruda Infusionskonzentrat 100mg/4ml)