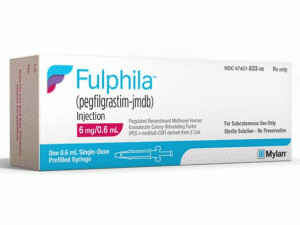
培非格司亭-jmdb预充注射器(Fulphila injection 6mg/0.6mL)说明书
 产地国家:美国
处 方 药:是
所属类别:6毫克/0.6毫升/套件
包装规格:6毫克/0.6毫升/套件
计价单位:套件
生产厂家中文参考译名:
Mylan GmbH
生产厂家英文名:
Mylan GmbH
原产地英文商品名:
Fulphila prefilled syringe 6mg/0.6mL/kit
原产地英文药品名:
pegfilgrastim-jmdb
中文参考商品译名:
Fulphila预充注射器 6毫克/0.6毫升/套件
中文参考药品译名:
培非司亭-jmdb
简介:
近日,FDA批准Neulasta的第一个生物仿制药Fulphila (pegfilgrastim-jmdb)上市,用于降低中性粒细胞减少的感染和发热风险。Fulphila是FDA批准的第10个生物类似物,也是安进Neulasta (pegfilgrastim,培非格司亭)的首个生物类似物。
批准日期:2018年6月25日 公司:Mylan公司
FULPHILA(pegfilgrastim-jmdb)注射液,用于皮下使用
作用机制
Pegfilgrastim产品是集落刺激因子,通过与特定细胞表面受体结合而作用于造血细胞,从而刺激增殖,分化,承诺和终止细胞功能激活。
适应症和用法
Fulphila是一种白细胞生长因子
•减少非骨髓性恶性肿瘤患者接受与临床相关的骨髓抑制性抗癌药物的感染发生率,如发热性胃肠功能减退所致发热性中性粒细胞减少症发病率显着。
使用限制
Fulphila不适用于动员外周血祖细胞用于造血干细胞移植。
剂量和给药
•每个化疗周期皮下接受一次皮下抑制化疗6 mg的癌症患者。
o在细胞毒性化学疗法给药前14天和24小时之间不给药。
o对体重小于45 kg的儿科患者使用基于体重的剂量;参见表1。
剂量形式和强度
•注射:单剂量预充式注射器中的6mg/0.6mL溶液仅供手动使用。
禁忌症
对人粒细胞集落刺激因子如pegfilgrastim或非格司亭产品有严重过敏反应史的患者。
警告和注意事项
•致命的脾脏破裂:评估报告左上腹肩痛的患者脾脏肿大或脾脏破裂。
•急性呼吸窘迫综合征(ARDS):评估发热,肺部浸润或呼吸窘迫的患者。 ARDS患者停用Fulphila。
•严重的过敏反应,包括过敏反应:对患有严重过敏反应的患者永久性地停用Fulphila。
•致命的镰状细胞危象:已经发生过。
•肾小球肾炎:如果可能存在因果关系,评估并考虑Fulphila的剂量减少或中断。
不良反应
最常见的不良反应(与安慰剂相比,发病率差异≥5%)是骨痛和四肢疼痛。
要报告疑似不良反应,请致电1-877-446-3679(1-877-4-INFO-RX)或美国食品药品局1-800- FDA-1088或www.fda.gov/medwatch联系Mylan。
有关患者咨询信息和FDA批准的患者标签,请参见17*生物仿制药意味着生物产品基于数据证明它与FDA批准的生物产品高度相似,称为参考产品,并且生物仿制药产品和参考产品之间没有临床意义上的差异。
已经证明了Fulphila的生物相似性用于使用条件(例如适应症,给药方案),强度,剂型和给药途径信息。
如何提供/存储和处理
Fulphila单剂量预充式注射器,供手动使用
Fulphila(培非司亭-jmdb)注射剂是在预填充单剂量注射器含6毫克培非司亭,jmdb手动使用供给的澄清,无色溶液,用29号,1/2英寸针头供给与超安全无源加™护针。
Fulphila以包含一个无菌6mg/0.6mL预装注射器的分配包装提供。
NDC 67457-833-06
Fulphila预充式注射器不带刻度标记,仅用于输送注射器的全部内容物(6 mg/0.6mL)直接给药。对于体重小于45千克且需要量小于注射器全部剂量的儿科患者,直接给药时,不建议使用预充式注射器。
将冷藏温度保存在纸箱中2°至8°C(36°至46°F)之间,以防止光线照射。
产地国家:美国
处 方 药:是
所属类别:6毫克/0.6毫升/套件
包装规格:6毫克/0.6毫升/套件
计价单位:套件
生产厂家中文参考译名:
Mylan GmbH
生产厂家英文名:
Mylan GmbH
原产地英文商品名:
Fulphila prefilled syringe 6mg/0.6mL/kit
原产地英文药品名:
pegfilgrastim-jmdb
中文参考商品译名:
Fulphila预充注射器 6毫克/0.6毫升/套件
中文参考药品译名:
培非司亭-jmdb
简介:
近日,FDA批准Neulasta的第一个生物仿制药Fulphila (pegfilgrastim-jmdb)上市,用于降低中性粒细胞减少的感染和发热风险。Fulphila是FDA批准的第10个生物类似物,也是安进Neulasta (pegfilgrastim,培非格司亭)的首个生物类似物。
批准日期:2018年6月25日 公司:Mylan公司
FULPHILA(pegfilgrastim-jmdb)注射液,用于皮下使用
作用机制
Pegfilgrastim产品是集落刺激因子,通过与特定细胞表面受体结合而作用于造血细胞,从而刺激增殖,分化,承诺和终止细胞功能激活。
适应症和用法
Fulphila是一种白细胞生长因子
•减少非骨髓性恶性肿瘤患者接受与临床相关的骨髓抑制性抗癌药物的感染发生率,如发热性胃肠功能减退所致发热性中性粒细胞减少症发病率显着。
使用限制
Fulphila不适用于动员外周血祖细胞用于造血干细胞移植。
剂量和给药
•每个化疗周期皮下接受一次皮下抑制化疗6 mg的癌症患者。
o在细胞毒性化学疗法给药前14天和24小时之间不给药。
o对体重小于45 kg的儿科患者使用基于体重的剂量;参见表1。
剂量形式和强度
•注射:单剂量预充式注射器中的6mg/0.6mL溶液仅供手动使用。
禁忌症
对人粒细胞集落刺激因子如pegfilgrastim或非格司亭产品有严重过敏反应史的患者。
警告和注意事项
•致命的脾脏破裂:评估报告左上腹肩痛的患者脾脏肿大或脾脏破裂。
•急性呼吸窘迫综合征(ARDS):评估发热,肺部浸润或呼吸窘迫的患者。 ARDS患者停用Fulphila。
•严重的过敏反应,包括过敏反应:对患有严重过敏反应的患者永久性地停用Fulphila。
•致命的镰状细胞危象:已经发生过。
•肾小球肾炎:如果可能存在因果关系,评估并考虑Fulphila的剂量减少或中断。
不良反应
最常见的不良反应(与安慰剂相比,发病率差异≥5%)是骨痛和四肢疼痛。
要报告疑似不良反应,请致电1-877-446-3679(1-877-4-INFO-RX)或美国食品药品局1-800- FDA-1088或www.fda.gov/medwatch联系Mylan。
有关患者咨询信息和FDA批准的患者标签,请参见17*生物仿制药意味着生物产品基于数据证明它与FDA批准的生物产品高度相似,称为参考产品,并且生物仿制药产品和参考产品之间没有临床意义上的差异。
已经证明了Fulphila的生物相似性用于使用条件(例如适应症,给药方案),强度,剂型和给药途径信息。
如何提供/存储和处理
Fulphila单剂量预充式注射器,供手动使用
Fulphila(培非司亭-jmdb)注射剂是在预填充单剂量注射器含6毫克培非司亭,jmdb手动使用供给的澄清,无色溶液,用29号,1/2英寸针头供给与超安全无源加™护针。
Fulphila以包含一个无菌6mg/0.6mL预装注射器的分配包装提供。
NDC 67457-833-06
Fulphila预充式注射器不带刻度标记,仅用于输送注射器的全部内容物(6 mg/0.6mL)直接给药。对于体重小于45千克且需要量小于注射器全部剂量的儿科患者,直接给药时,不建议使用预充式注射器。
将冷藏温度保存在纸箱中2°至8°C(36°至46°F)之间,以防止光线照射。
用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 培非格司亭-jmdb预充注射器(Fulphila injection 6mg/0.6mL)说明书
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 培非格司亭-jmdb预充注射器(Fulphila injection 6mg/0.6mL)说明书