威罗菲尼薄膜片(vemurafenib )说明书
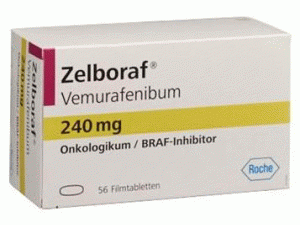 产地国家:瑞士
处 方 药:是
所属类别:240毫克/片 56片/盒
包装规格:240毫克/片 56片/盒
计价单位:瓶
生产厂家中文参考译名:
罗氏公司
生产厂家英文名:
Roche Pharma (Schweiz) AG
原产地英文商品名:
Zelboraf Filmtabletten 240mg/tab 56tab/box
原产地英文药品名:
vemurafenib
中文参考商品译名:
Zelboraf 240毫克/片 56片/盒
中文参考药品译名:
威罗菲尼
英文名:Vémurafénib
商品名:Zelboraf Filmtabl
中文名:威罗菲尼薄膜片
生产商:罗氏公司
药品简介
2012年2月20日,欧盟委员会批准抗癌新物Zelboraf,用于治疗成人BRAF V600突变阳性、经手术不能切除或转移性黑色素瘤。
在早期时若能确诊,黑色素瘤一般是可以治愈的,而当它扩散到身体的其他部位时,就成了一种致命性的皮肤癌。目前,在诊断后仅有四分之一的患者能生活超过一年的时间。
作用机制
威罗菲尼是一种低分子量,的BRAF丝氨酸苏氨酸激酶的一些突变的形式,包括BRAF V600E口服可利用抑制剂。威罗菲尼还抑制在体外其它激酶例如CRAF,ARAF,野生型BRAF,SRMS,ACK1,MAP4K5,和FGR在相似浓度。在BRAF基因包括V600E导致组成性活化的BRAF蛋白,其可引起细胞增殖在不存在生长因子的通常会被需要用于增殖一些突变。威罗菲尼具有在细胞和动物模型中的抗肿瘤作用具有突变的BRAF V600E的黑素瘤。
适应症和用法
ZELBORAF是用于治疗患者的由FDA批准的试验,检测到与BRAF V600E突变不能切除或转移性黑素瘤指示的激酶抑制剂。
ZELBORAF的适应症为治疗的患者Erdheim-切斯特疾病与BRAF V600突变。
使用的限制:ZELBORAF不进行治疗的患者与野生型BRAF黑色素瘤表示。
剂量和用量
在开始用ZELBORAF治疗之前,确认肿瘤标本中存在BRAF V600E突变。
推荐剂量:960毫克口服,每日两次,间隔约12小时,有或没有用餐。
剂量形式和强度
片剂:240毫克
警告和注意事项
新的主皮肤恶性肿瘤:治疗开始之前执行皮肤病的评价,每2个月,而在治疗和长达6个月后ZELBORAF停药管理与切除和继续治疗无需调整剂量。
新的非皮肤鳞状细胞癌:评估为症状或治疗开始前,新的非皮肤鳞状细胞癌的临床症状和治疗期间定期。
其他恶性肿瘤:监测接受ZELBORAF的患者是否接受其他恶性肿瘤的体征或症状。
BRAF野生型黑素瘤中的肿瘤促进:BRAF抑制剂可以增加细胞增殖。
严重超敏性反应包括过敏性休克和嗜酸性粒细胞药物不良反应和全身症状(DRESS综合症):请停止ZELBORAF严重的过敏反应。
严重的皮肤病反应,包括史蒂文斯-约翰逊综合征和中毒性表皮坏死松解症:请停止ZELBORAF严重皮肤病反应。
QT延长:监测心电图和之前和期间治疗扣压ZELBORAF为500毫秒的QT间期或更高纠正电解质异常和控制QT间期延长心脏危险因素的电解质。
肝毒性:在开始ZELBORAF之前测量肝酶和胆红素,并在治疗期间每月监测一次。
光敏性:建议患者避免阳光照射。
严重的眼科反应:监测葡萄膜炎的体征和症状。
胚胎-胎儿毒性:能引起的潜在的风险对胎儿的胎儿造成伤害的女性提供咨询,并使用有效的避孕措施。
辐射敏化和辐射回收:已报告严重病例。
肾功能衰竭:在开始ZELBORAF之前测量血清肌酐并在治疗期间定期监测。
腱膜挛缩症和足底筋膜纤维瘤病:活动应该减少剂量,治疗中断或停止治疗来管理。
不良反应
黑色素瘤:最常见的不良反应(≥30%)是关节痛,皮疹,脱发,疲劳,光敏性反应,恶心,瘙痒和皮肤乳头状瘤。
Erdheim-切斯特疾病:最常见的不良反应(>50%)是关节痛,皮疹maculo-丘疹,脱发,疲劳,心电图QT间期延长,和皮肤乳头状瘤。
药物相互作用
避免同时使用强力CYP 3A4抑制剂或诱导剂给予ZELBORAF。
CYP1A2底物:ZELBORAF可提高CYP1A2底物浓度避免与CYP1A2底物同时使用ZELBORAF的具有窄治疗窗如果不能避免共同给药,对于毒性密切监视,并考虑CYP1A2底物的剂量减少。
用于特定人群
哺乳期:服用ZELBORAF时不要母乳喂养。
产地国家:瑞士
处 方 药:是
所属类别:240毫克/片 56片/盒
包装规格:240毫克/片 56片/盒
计价单位:瓶
生产厂家中文参考译名:
罗氏公司
生产厂家英文名:
Roche Pharma (Schweiz) AG
原产地英文商品名:
Zelboraf Filmtabletten 240mg/tab 56tab/box
原产地英文药品名:
vemurafenib
中文参考商品译名:
Zelboraf 240毫克/片 56片/盒
中文参考药品译名:
威罗菲尼
英文名:Vémurafénib
商品名:Zelboraf Filmtabl
中文名:威罗菲尼薄膜片
生产商:罗氏公司
药品简介
2012年2月20日,欧盟委员会批准抗癌新物Zelboraf,用于治疗成人BRAF V600突变阳性、经手术不能切除或转移性黑色素瘤。
在早期时若能确诊,黑色素瘤一般是可以治愈的,而当它扩散到身体的其他部位时,就成了一种致命性的皮肤癌。目前,在诊断后仅有四分之一的患者能生活超过一年的时间。
作用机制
威罗菲尼是一种低分子量,的BRAF丝氨酸苏氨酸激酶的一些突变的形式,包括BRAF V600E口服可利用抑制剂。威罗菲尼还抑制在体外其它激酶例如CRAF,ARAF,野生型BRAF,SRMS,ACK1,MAP4K5,和FGR在相似浓度。在BRAF基因包括V600E导致组成性活化的BRAF蛋白,其可引起细胞增殖在不存在生长因子的通常会被需要用于增殖一些突变。威罗菲尼具有在细胞和动物模型中的抗肿瘤作用具有突变的BRAF V600E的黑素瘤。
适应症和用法
ZELBORAF是用于治疗患者的由FDA批准的试验,检测到与BRAF V600E突变不能切除或转移性黑素瘤指示的激酶抑制剂。
ZELBORAF的适应症为治疗的患者Erdheim-切斯特疾病与BRAF V600突变。
使用的限制:ZELBORAF不进行治疗的患者与野生型BRAF黑色素瘤表示。
剂量和用量
在开始用ZELBORAF治疗之前,确认肿瘤标本中存在BRAF V600E突变。
推荐剂量:960毫克口服,每日两次,间隔约12小时,有或没有用餐。
剂量形式和强度
片剂:240毫克
警告和注意事项
新的主皮肤恶性肿瘤:治疗开始之前执行皮肤病的评价,每2个月,而在治疗和长达6个月后ZELBORAF停药管理与切除和继续治疗无需调整剂量。
新的非皮肤鳞状细胞癌:评估为症状或治疗开始前,新的非皮肤鳞状细胞癌的临床症状和治疗期间定期。
其他恶性肿瘤:监测接受ZELBORAF的患者是否接受其他恶性肿瘤的体征或症状。
BRAF野生型黑素瘤中的肿瘤促进:BRAF抑制剂可以增加细胞增殖。
严重超敏性反应包括过敏性休克和嗜酸性粒细胞药物不良反应和全身症状(DRESS综合症):请停止ZELBORAF严重的过敏反应。
严重的皮肤病反应,包括史蒂文斯-约翰逊综合征和中毒性表皮坏死松解症:请停止ZELBORAF严重皮肤病反应。
QT延长:监测心电图和之前和期间治疗扣压ZELBORAF为500毫秒的QT间期或更高纠正电解质异常和控制QT间期延长心脏危险因素的电解质。
肝毒性:在开始ZELBORAF之前测量肝酶和胆红素,并在治疗期间每月监测一次。
光敏性:建议患者避免阳光照射。
严重的眼科反应:监测葡萄膜炎的体征和症状。
胚胎-胎儿毒性:能引起的潜在的风险对胎儿的胎儿造成伤害的女性提供咨询,并使用有效的避孕措施。
辐射敏化和辐射回收:已报告严重病例。
肾功能衰竭:在开始ZELBORAF之前测量血清肌酐并在治疗期间定期监测。
腱膜挛缩症和足底筋膜纤维瘤病:活动应该减少剂量,治疗中断或停止治疗来管理。
不良反应
黑色素瘤:最常见的不良反应(≥30%)是关节痛,皮疹,脱发,疲劳,光敏性反应,恶心,瘙痒和皮肤乳头状瘤。
Erdheim-切斯特疾病:最常见的不良反应(>50%)是关节痛,皮疹maculo-丘疹,脱发,疲劳,心电图QT间期延长,和皮肤乳头状瘤。
药物相互作用
避免同时使用强力CYP 3A4抑制剂或诱导剂给予ZELBORAF。
CYP1A2底物:ZELBORAF可提高CYP1A2底物浓度避免与CYP1A2底物同时使用ZELBORAF的具有窄治疗窗如果不能避免共同给药,对于毒性密切监视,并考虑CYP1A2底物的剂量减少。
用于特定人群
哺乳期:服用ZELBORAF时不要母乳喂养。
用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 威罗菲尼薄膜片(vemurafenib )说明书
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 威罗菲尼薄膜片(vemurafenib )说明书