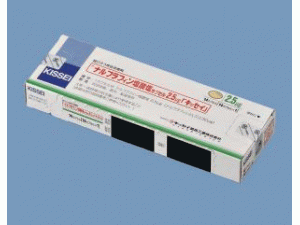
干扰素β注射剂Interferon Beta(Feron kit 300UI)说明书
 产地国家:日本
处方药:是
所属类别: 300万单位/瓶+2毫升盐水溶液
包装规格: 300万单位/瓶+2毫升盐水溶液
计价单位:套
生产厂家英文名:First Sankyo Corporation
原产地英文商品名:Feron(フエロン注射用)300UI/kit
原产地英文药品名:Interferon Beta
中文参考商品译名:Feron(フエロン注射用)300万单位/套
中文参考药品译名:干扰素β
产地国家:日本
处方药:是
所属类别: 300万单位/瓶+2毫升盐水溶液
包装规格: 300万单位/瓶+2毫升盐水溶液
计价单位:套
生产厂家英文名:First Sankyo Corporation
原产地英文商品名:Feron(フエロン注射用)300UI/kit
原产地英文药品名:Interferon Beta
中文参考商品译名:Feron(フエロン注射用)300万单位/套
中文参考药品译名:干扰素β
简介
部份中文干扰素β处方资料(仅供参考) 英文名:Interferon Beta 商品名:FERON 中文名:干扰素β 生产商:第一三共フエロン注射用100万/フエロン注射用300万 药物类别名称:天然干扰素β配方 批准日期:2009年9月 商标名:FERON(1×106IU)FERON(3×106IU) 一般名:Interferon Beta(インターフェロン ベータ) 惯用名:HuIFN-β(ヒトインターフェロン-β) 构造式:糖鎖を結合したアミノ酸166個からなるポリペプチド 分子式:C908H1406N246O252S7(ポリペプチド部分のみ) 分子量: 20024.83(ポリペプチド部分のみ)SDS-PAGE法による実測値約22000(糖鎖を含む)6. 性状在白色质量或粉末中,纯化水,很容易溶于盐水溶液和5%葡萄糖注射液,加入盐水溶液溶解时无色透明液体。 药用药理学 1. 抗肿瘤作用 (1) 体外当药物103IU/mL治疗人脑肿瘤衍生细胞系(AJ)时,观察到显著的生长抑制。还观察到人类恶性黑色素瘤衍生细胞系(HMV-1)(IC50:130IU/mL)的强生长抑制。 (2) 体内在裸鼠中移植恶性胶质瘤衍生细胞系(Gl-MK)后,经观察,通过腹内给导来抑制肿瘤生长。Gl-MK和胶质细胞瘤衍生细胞系(Gl-AK)在裸鼠中分皮移植,肿瘤内分因观察到显著的生长抑制。在肿瘤组织中,细胞成分显著减少、核浓度显著降低、细胞质形成增加等,表现出显著的抗肿瘤作用。将多态胶质细胞瘤衍生细胞系(GL-5-JCK)移植到裸鼠体内后,通过静脉给给或肿瘤内给给观察到显著的生长抑制。此外,在将人类恶性黑色素瘤衍生细胞系(HMV-1)移植到裸鼠体内后,肿瘤内分因观察到显著的生长抑制。 (3) 作用机制它与肿瘤细胞表面结合,通过宿主激活抗肿瘤免疫能力,抑制肿瘤生长的直接作用,被认为是抑制肿瘤生长的间接作用。 2. 抗病毒行动 (1) 体外使用人类胎儿皮肤衍生的HES/YS细胞进行通宵治疗后,接种了各种RNA和DNA病毒,并观察到抗病毒作用,顺序为VSV-HSV-1_腺病毒类型3,19型19+腺病毒类型4+腺病毒类型。使用带乙型肝炎病毒(HBV)DNA的人类肝细胞细胞的HepG2细胞,用该制剂治疗3天后,观察到hbv在细胞中的复制抑制。使用感染丙型肝炎病毒(HCV)的人类T淋巴细胞,使用这种药物治疗8天后,观察到细胞中的hcv复制抑制。 (2) 体内对于兔角膜疱疹病毒感染,这种药物1.4×105IU局部施用(眼药水),以确认抗病毒效果。 (3) 作用机制它通过细胞膜上的受体作用于细胞膜,2-5A合成酶,诱导蛋白激酶等,它被认为使细胞处于抗病毒状态。 适应症 1.胶质母细胞瘤,髓母细胞瘤,星细胞癌。 2.皮肤恶性黑色素瘤。 3.改善HBe抗原阳性和DNA聚合酶阳性的B型慢性活性肝炎病毒症。 4.慢性丙型肝炎病毒血症的改善。 5.与利巴韦林结合,改善以下任何慢性丙型肝炎的病毒血症。 6.C补偿性肝硬化病毒血症的改善(HCV大提琴组1血液中HCV-RNA的含量高时除外) 用量用法 1.胶质母细胞瘤,髓母细胞瘤,星细胞癌静脉注射溶解在盐水溶液或5%葡萄糖注射液等,通常,成人静脉注射静脉注射每天100万至600万国际单位。应根据年龄和症状,酌情调整增加或减少。 2.皮肤恶性黑色素瘤溶解在适当数量的附加溶酶,通常,成人管理40万至80万国际单位每个病变每天一次在肿瘤或其外围。每日总剂量为100万至300万国际单位。注意肿瘤的大小,情况和年龄,根据症状适当增加或减少。 3.改善HBe抗原阳性和DNA聚合酶阳性的B型慢性活性肝炎病毒症静脉注射或静脉静脉注射溶于盐水溶液或5%葡萄糖注射液或类似,通常,成人一次300万国际单位一次的第一天,每天1-2次,此后6天,一次静脉注射或静脉静脉注射解液一次,每天从第二周开始。 4.慢性丙型肝炎病毒血症的改善静脉注射或静脉静脉注射在使用中,hcv-RNA被确认为阳性。溶解在盐水溶液或5%葡萄糖注射液等,通常,成人一次300万至600万国际单位每天静脉注射或静脉注射。 5.与利巴韦林结合,改善以下任何慢性丙型肝炎的病毒血症(1) 血液中HCV-RNA含量高的患者(2) 干扰素制备单位治疗致残患者或干扰素制备单次治疗后复发的患者静脉注射或静脉静脉注射在使用中,hcv-RNA被确认为阳性。溶解在盐水溶液或5%葡萄糖注射液或类似,通常,成人开始给给600万国际单位每天,每天直到4周后给给,静脉注射或静脉注射后,每周三次。 6.C补偿性肝硬化病毒血症的改善(HCV大提琴组1血液中HCV-RNA的含量高时除外)静脉注射或静脉静脉注射在使用中,hcv-RNA被确认为阳性。溶解在盐水溶液或5%葡萄糖注射液或类似,通常,成人开始管理在600万国际单位每天,直到6周后,每天300万至600万国际单位,此后每天300万国际单位静脉注射或静脉注射。 临床表现 1. 胶质母细胞瘤,髓母细胞瘤,星细胞癌8例胶质细胞瘤57例(14.0%)在静脉注射或局部给政主要以1.0至6.0~106IU每天,4例髓母细胞瘤20例(20.0%),6例星细胞癌(24.0%)被观察疗效。 2. 皮肤恶性黑色素瘤在局部给用的20例(50.0%)中,在10例(50.0%)中观察到疗效,主要是每天1.0至3.0~106IU。此外,还观察到3例3年以上的存活率,三年生存率为28.2%。注意病变不同效率为75.4%(在211个病变的159个病变中有效)。 3. HBe抗原阳性和DNA聚合酶阳性B型慢性活性肝炎病毒血症的改善每日3.0至6.0~106IU通过静脉静脉输注给72例。脱氧核糖核酸聚合酶(DNA-P)为48.0%(24/50),在分因结束后立即呈阴性。HBe抗原阴性(血清阴性:SN)率,HBe抗体阳性(血清转化:SC)率分别为16.9%(12/71),1.4%(1/71),在分期结束后6个月内为22.6% (12/53), 5.7% (3/53)。 在长期跟踪研究中,药物管理结束后第二年的SN率为40-50%,SC率为23-30%。对69例采用双盲法进行了比较试验,与对照组相比,dna-P(降至阴性或剂量前值的1/10或更少)显著改善。每天3.0至6.0~106IU在44例中静脉注射。脱氧核糖核酸-P在给给后立即为44.1%(15/34)为阴性,SN率为14.3%(6/42),相当于静脉注射滴注的结果。 4. 慢性丙型肝炎病毒血症的改善每日6.0~106IU在110例中静脉注射或静脉静脉注射6周。在管理结束后,一个多月的正常管理被观察了。有效率(包括完成管理(有效)后6个月或6个月以上正常上限的2倍为61.8%(68/110)。分理后6个月丙肝病毒-RNA的阴性率为15.6%(7/45)。 在慢性不活动丙型肝炎(56例),HCV基因型(基因型)和HCV-RNA量(CRT-PCR方法)6个月后完成另一组公理HCV-RNA阴性率(CRT-PCR方法)和ALT(GPT)显著效率, 具体如下。表5 "HCV基因型(基因型)和丙肝-RNA量按慢性不活动性丙型肝炎(CRT-PCR方法)的HCV-RNA量(CRT-PCR方法)完成6个月后,另一组丙肝-RNA阴性率(CRT-PCR方法)和ALT(GPT)的效率"。 在批准条件下进行的一项特别调查中,500例慢性丙型肝炎病例, HCV大提琴组和HCV-RNA量(丙基核法)HCV-RNA阴性率6个月后,另一组(丙基核法)和ALT(GPT)的效率影响如下。表6 "HCV-RNA阴性率在HCV大提琴组和丙肝-RNA量(丙核方法)完成6个月后,在慢性丙型肝炎(丙肝方法)和ALT(GPT)中按效率进行另一次分管"。 5. 与利巴韦林结合改善慢性丙型肝炎病毒血症 (1) 24周管理的结果"HCV大提琴组1和血液中高含量的HCV-RNA患者:目标A"和"血液中HCV-RNA含量高的患者,但HCV大提琴组1与IFN制剂治疗史的血液HCV-RNA的HCV-RNA含量低的患者:针对"目标B",在服用此药四周后6.0~106IU,6.0~106IU,每周3天,每周3周, IfN_-2b/是一个对照药物组与目前的代理/利巴韦林组合组时,结合600~800mg每天24周 HCV-RNA阴性率24周后完成HCV大提琴组和HCV-RNA量(丙基核方法)的另一组在利巴韦林组合组(阿普曲核方法)如下。见表7"HCV-RNA阴性率24周后完成hcv大提琴组和HCV-RNA量(丙肝核素方法)后,慢性丙型肝炎与利巴韦林(阿曲核方法)联合的另一组。 (2) 48周管理的结果慢性丙型肝炎患者,HCV大提琴组1中含有高血HCV-RNA含量,抑郁症史(包括干扰素α制剂抑郁症史), 或对于抑郁症或慢性丙型肝炎并发症的患者有或怀疑(汉密尔顿抑郁症评估表17项的总分是13或更少),在服用此药四周后6.0×106IU, 6.0×106IU每周3次44周, Ribavirin每天400~1,000毫克由精神病医生定期检查后进行,联合进行48周的试验。 开始24周后,48周后为8.6%,分别为17.2%(10/58),48周后24周的HCV-RNA阴性率为22.4%(13/58)。6. C补偿性肝硬化病毒血症的改善(HCV大提琴组1血液中HCV-RNA的含量高时除外)静脉注射或静脉输注,每日给药6.0~106IU1周,每天施用6-7周,每日3.0~106IU,每周6次,然后共施用20-22周或共34-36周, Hcv-RNA阴性率6个月后完成分因(共发方法)和ALT(GPT)的影响如下。表8 "丙肝-RNA阴性率在按管理期按管理期6个月按管理期(按管理期)分在C型补偿性肝硬化(丙肝素法)和ALT(GPT)中按效率进行"。 此外,当该试剂由HCV大提琴组施用20周或以上时,HCV-RNA量(bDNA探针法)在完成另一组HCV-RNA阴性率和ALT(GPT)后6个月,其效率影响如下。表9 "按丙肝细胞大提琴组在C型补偿性肝硬化,HCV-RNA量(bDNA探针法)由另一组6个月后完成HCV-RNA阴性率和ALT(GPT)的效率"。 在生产后临床试验中,静脉注射或静脉静脉输注,由于在以下用法和剂量下施用,第三组对I组的优势未显示。第一组:每天6.0~106IU,5周后3.0~106IU,第七周后共3.0~106IU,每周3次给药期34-36周,总剂量3.99亿IU第二组:每天6.0~106IU,3.0~106IU后5周,第七周后每天3.0~106IU,每周共168剂3次(给药期48至50周,总剂量5.25亿IU)III组:6.0~106IU,每天6周,后7周共施用3.0~106IU,每周三次共施用168次(施用期48-50周,总剂量6.3亿IU)HCV-RNA阴性率后,每个组24周(共发方法或共体TaqMan HCV方法)和ALT持久性正常化率如下。 表10"丙肝-RNA阴性率在给给24周后,每组在C型补偿性肝硬化(丙核方法或共体TaqMan HCV方法)和ALT持久性正常化率"参考。BY HCV CELLO 集团, HCV-RNA 量(AMPLICCORE HCV 监测方法或COBUS Taqman HCV 方法) HCV-RNA 的负速率在24周的管理结束之后。 表11 "丙肝细胞群在C型补偿性肝硬化中,HCV-RNA量(丙核丙肝病毒监测方法或共体TaqMan HCV方法)是指HCV-CELLO组在再次结束给政24周后呈阴性率"。此外,延长体重减轻或管理间隔的病例数和已停产病例的百分比如下。表12 "C型补偿性肝硬化中体重减轻或给位间隔增加的病例和已停止病例的百分比"。 包装规格 10万 1瓶注射(附:(2mL) 日本盐水溶液)。300万 1瓶注射(附:(2mL) 日本盐水溶液) 制造和销售Toray Co.Ltd.販売元第一三共株式会社注:以上中文处方资料不够完整,使用者以原处方资料为准。用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 干扰素β注射剂Interferon Beta(Feron kit 300UI)说明书
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 干扰素β注射剂Interferon Beta(Feron kit 300UI)说明书