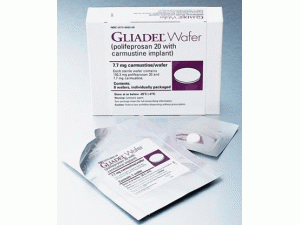
卡莫司汀植入膜剂Gliadel waffr 7.7mg Implant
 药店国别:
产地国家:美国
处方药:是
所属类别: 7.7毫克/片,8片/盒
包装规格: 7.7毫克/片,8片/盒
计价单位:盒
生产厂家中文参考译名:
生产厂家英文名:MGI PHARMA LIMITED
原产地英文商品名:GLIADEL WAFER 7.7mg/Implant 8Implant
原产地英文药品名:Polifeprosan 20 with Carmustine Implant
中文参考商品译名:GLIADEL植入剂 7.7毫克/片 8片/盒
中文参考药品译名:卡莫司汀植入膜剂
曾用名:卡氮芥、氯乙亚硝脲、亚硝基脲芥
简介:
美国FDA于1996年批准Guilford公司研发,以BCNU为活性成分,聚苯丙生20为释放基质,制成植入药物芯片Gliadel,治疗复发性恶性脑瘤,可在手术后,将药物直接放置于复发性恶性胶质细胞瘤之脑组织中,让药物缓慢释放,进行持续性化学治疗。经过多年多中心临床试验,FDA于2003年加大其治疗适应症,批准Gliadel用于原发性恶性脑瘤的治疗,据文献报道,Gliadel可延长原发性及复发性恶性脑瘤患者的中间存活期。
该治疗方法的独特之处在于其给药方式及释放系统。在外科手术过程中,先将肿瘤组织切除,留下一个小空腔,然后植入这种定期释放的芯片。这些芯片会在2~3周之内慢慢地分解、融化,释放出的药物可直接进入肿瘤区,杀死那些在外科手术中没有切除干净的肿瘤细胞,并且能在不损害其它组织的情况下使病变局部能达到有效的血药浓度,延缓了疾病的进展。
美国癌症中心联盟(National Comprehensive Cancer Network, NCCN)针对恶性脑瘤的最新治疗原则中指出,原发及复发恶性脑瘤患者皆可予以手术切除肿瘤时同时置入Gliadel(BCNU),术后辅以放射线治疗或Temozolomide等化疗药物治疗,据文献报道,采用此治疗模式可有效延长患者的存活中位数。批准日期:1996年 公司:ARBOR PHARMACEUTICALS INCGLIADEL WAFER (卡莫司汀[carmustine implant])植入物, 脑内用胶粉晶片美国最初批准:1996年
作用机制
GLIADEL Wafer活性的升高是由于肿瘤切除腔内释放出carmustine(一种DNA和RNA烷基化剂)的细胞毒性浓度。在切除腔的水环境中,共聚物中的茶酐键被水解,释放出卡莫司汀、羧基苯氧丙烷和癸二酸进入周围的脑组织。适应症和用法GLIADEL Wafer是一种用于治疗:•新诊断的高等级恶性胶质瘤作为外科手术和放疗的辅助手段。复发性多型胶质母细胞瘤作为外科手术的辅助治疗。
剂量和管理
•推荐剂量:8片7.7mg晶圆片(总剂量61.6mg)植入颅内。•遵循准备和处理建议。剂型及强度•每个GLIADEL晶圆片含有7.7毫克carmustine。
禁忌症
没有
警告和预防措施
•癫痫发作:监测患者植入后的癫痫发作情况。•颅内压升高:监测患者颅内压升高的迹象。神经外科伤口愈合受损:监测患者开颅手术并发症。•脑膜炎:监测患者是否有细菌性或化学性脑膜炎症状。•晶片迁移:监测患者是否有阻塞性脑积水的迹象。胚胎-胎儿毒性:可导致胎儿伤害。
不良反应
•最近确诊高档恶性神经胶质瘤:最常见的不良反应(发生率≥4%)> 10%,betweenarm区别是脑水肿、无力、恶心、呕吐、便秘、伤口愈合abnormalitiesand萧条。•多形性成胶质细胞瘤复发:最常见的不良反应(发生率> 10%和手臂之间差异≥4%)是尿路感染,伤口healingabnormalities和发热。
用于特定人群
•儿科使用:安全性和有效性尚未确定。包装提供/存储和处理GLIADEL晶圆片装在一个单剂量处理盒中,包含8个单独的袋状晶圆片。每个晶圆片含有7.7毫克卡莫司汀,包装在两个铝箔层压板袋中。内袋是无菌的,旨在保持产品的无菌性和保护产品的水分。外袋是一层可剥的外皮。外袋的外表面不是无菌的。单剂量治疗盒NDC: 24338-050-08商店GLIADEL晶片达到或者低于-20ºC(4ºF)。在30天内,不可将未开封的箔袋在室温下保存超过6小时,每次最多可保存3周。GLIADEL Wafer是一种细胞毒性药物,需要考虑特殊处理和处理流程。
药店国别:
产地国家:美国
处方药:是
所属类别: 7.7毫克/片,8片/盒
包装规格: 7.7毫克/片,8片/盒
计价单位:盒
生产厂家中文参考译名:
生产厂家英文名:MGI PHARMA LIMITED
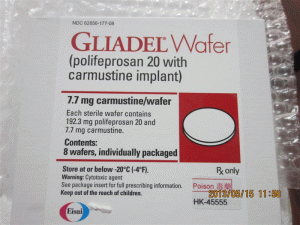
原产地英文商品名:GLIADEL WAFER 7.7mg/Implant 8Implant
原产地英文药品名:Polifeprosan 20 with Carmustine Implant
中文参考商品译名:GLIADEL植入剂 7.7毫克/片 8片/盒
中文参考药品译名:卡莫司汀植入膜剂
曾用名:卡氮芥、氯乙亚硝脲、亚硝基脲芥
简介:
美国FDA于1996年批准Guilford公司研发,以BCNU为活性成分,聚苯丙生20为释放基质,制成植入药物芯片Gliadel,治疗复发性恶性脑瘤,可在手术后,将药物直接放置于复发性恶性胶质细胞瘤之脑组织中,让药物缓慢释放,进行持续性化学治疗。经过多年多中心临床试验,FDA于2003年加大其治疗适应症,批准Gliadel用于原发性恶性脑瘤的治疗,据文献报道,Gliadel可延长原发性及复发性恶性脑瘤患者的中间存活期。
该治疗方法的独特之处在于其给药方式及释放系统。在外科手术过程中,先将肿瘤组织切除,留下一个小空腔,然后植入这种定期释放的芯片。这些芯片会在2~3周之内慢慢地分解、融化,释放出的药物可直接进入肿瘤区,杀死那些在外科手术中没有切除干净的肿瘤细胞,并且能在不损害其它组织的情况下使病变局部能达到有效的血药浓度,延缓了疾病的进展。
美国癌症中心联盟(National Comprehensive Cancer Network, NCCN)针对恶性脑瘤的最新治疗原则中指出,原发及复发恶性脑瘤患者皆可予以手术切除肿瘤时同时置入Gliadel(BCNU),术后辅以放射线治疗或Temozolomide等化疗药物治疗,据文献报道,采用此治疗模式可有效延长患者的存活中位数。批准日期:1996年 公司:ARBOR PHARMACEUTICALS INCGLIADEL WAFER (卡莫司汀[carmustine implant])植入物, 脑内用胶粉晶片美国最初批准:1996年
作用机制
GLIADEL Wafer活性的升高是由于肿瘤切除腔内释放出carmustine(一种DNA和RNA烷基化剂)的细胞毒性浓度。在切除腔的水环境中,共聚物中的茶酐键被水解,释放出卡莫司汀、羧基苯氧丙烷和癸二酸进入周围的脑组织。适应症和用法GLIADEL Wafer是一种用于治疗:•新诊断的高等级恶性胶质瘤作为外科手术和放疗的辅助手段。复发性多型胶质母细胞瘤作为外科手术的辅助治疗。
剂量和管理
•推荐剂量:8片7.7mg晶圆片(总剂量61.6mg)植入颅内。•遵循准备和处理建议。剂型及强度•每个GLIADEL晶圆片含有7.7毫克carmustine。
禁忌症
没有
警告和预防措施
•癫痫发作:监测患者植入后的癫痫发作情况。•颅内压升高:监测患者颅内压升高的迹象。神经外科伤口愈合受损:监测患者开颅手术并发症。•脑膜炎:监测患者是否有细菌性或化学性脑膜炎症状。•晶片迁移:监测患者是否有阻塞性脑积水的迹象。胚胎-胎儿毒性:可导致胎儿伤害。
不良反应
•最近确诊高档恶性神经胶质瘤:最常见的不良反应(发生率≥4%)> 10%,betweenarm区别是脑水肿、无力、恶心、呕吐、便秘、伤口愈合abnormalitiesand萧条。•多形性成胶质细胞瘤复发:最常见的不良反应(发生率> 10%和手臂之间差异≥4%)是尿路感染,伤口healingabnormalities和发热。
用于特定人群
•儿科使用:安全性和有效性尚未确定。包装提供/存储和处理GLIADEL晶圆片装在一个单剂量处理盒中,包含8个单独的袋状晶圆片。每个晶圆片含有7.7毫克卡莫司汀,包装在两个铝箔层压板袋中。内袋是无菌的,旨在保持产品的无菌性和保护产品的水分。外袋是一层可剥的外皮。外袋的外表面不是无菌的。单剂量治疗盒NDC: 24338-050-08商店GLIADEL晶片达到或者低于-20ºC(4ºF)。在30天内,不可将未开封的箔袋在室温下保存超过6小时,每次最多可保存3周。GLIADEL Wafer是一种细胞毒性药物,需要考虑特殊处理和处理流程。
用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 卡莫司汀植入膜剂Gliadel waffr 7.7mg Implant
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 卡莫司汀植入膜剂Gliadel waffr 7.7mg Implant



![环磷酰胺原末[口服散装粉]Cyclophosphamide Hydrate (Endoxan)](https://www.yschn.com/wp-content/uploads/2020/05/1592552449-6c48e6587d5611c.gif)