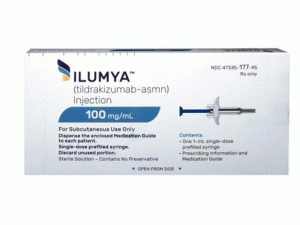
预装注射器ILUMYA injection 1mL 100mg(tildrakizumab-asmn )说明书
 产地国家:美国
处 方 药:是
所属类别:1毫升 100毫克/毫升支
包装规格:1毫升 100毫克/毫升支
计价单位:盒
生产厂家中文参考译名:
Sun Pharma
生产厂家英文名:
Sun Pharma
原产地英文商品名:
ILUMYA injection 1mL 100mg/mL/syringe
原产地英文药品名:
tildrakizumab-asmn
中文参考商品译名:
ILUMYA预装注射器 1毫升 100毫克/毫升支
中文参考药品译名:
tildrakizumab-asmn
简介:
近日,美国FDA批准新药ILUMYA(tildrakizumab-asmn)上市,治疗适合接受全身治疗或光疗的中度至重度斑块型银屑病成人患者。
银屑病是皮肤上出现的慢性免疫性疾病。它是一种非传染性疾病,可加速皮肤细胞的生长周期,并导致皮肤出现厚厚的鳞屑区域。最常见的银屑病形式为斑块型银屑病,影响了大约80%至90%的银屑病患者。斑块型银屑病通常表现为红色、凸起的皮肤区域覆盖有片状白色鳞片,可能会发痒、疼痛,并可能导致裂开和流血。许多患者需要持续生活在这种疾病带来的痛苦中,他们急需有效的治疗来缓解疾病,提高生活质量。
ILUMYA正是这样一款疗法。它可以选择性结合IL-23的p19亚基,并抑制其与IL-23受体作用,从而抑制促炎细胞因子和趋化因子的释放。在完成初始剂量的第0周和第4周,ILUMYA每12周通过皮下注射以100mg的剂量施用。ILUMYA不适合对tildrakizumab严重过敏的患者。
批准日期:2018年3月21日 公司:Sun Pharma
ILUMYA(tildrakizumab-asmn)注射液,用于皮下使用
作用机制
Tildrakizumab是人源化IgG1/k单克隆抗体,其选择性结合IL-23的p19亚基并抑制其与IL-23受体的相互作用。IL-23是天然存在的细胞因子,其参与炎症和免疫应答。Tildrakizumab抑制促炎细胞因子和趋化因子的释放。
适应症和用法
ILUMYA是一种白细胞介素-23拮抗剂,用于治疗中度至重度斑块状银屑病的成人,这些斑块状银屑病是全身治疗或光疗的候选者。
剂量和给药
•通过皮下注射给药。
•推荐剂量为第0周,第4周和每12周一次100毫克。
剂量形式和强度
注射:在单剂量预填充注射器中的100mg/mL溶液。
禁忌症
对tildrakizumab或任何接受者的严重超敏反应。
警告和注意事项
•过敏反应:如果发生严重的过敏反应,立即停用ILUMYA并开始适当的治疗。
•感染:ILUMYA可能会增加感染的风险。如果出现临床上重要的慢性或急性感染的体征或症状,请指导患者就医。如果严重感染发展,请考虑停止ILUMYA直至感染消退。
•结核病(TB):在开始治疗前评估结核病。
不良反应
最常见(≥1%)与ILUMYA相关的不良反应
治疗是上呼吸道感染,注射部位反应和腹泻。
要报告可疑的不良反应,请联系Sun
Pharmaceutical Industries,Inc。,1-800-818-4555或FDA,1-800-FDA-1088或www.fda.gov/medwatch。
药物相互作用
活疫苗:在使用ILUMYA治疗的患者中避免使用活疫苗。
包装提供/存储和处理
如何提供
ILUMYA(tildrakizumab-asmn)注射液是一种无菌,无防腐剂,透明至微乳白色,无色至微黄色溶液。ILUMYA作为一个单剂量预填充注射器提供,每个载体提供1mL 100mg/mL溶液。
•NDC 47335-177-95
每个预装注射器都配有被动针头护套和针头盖。
存储和处理
在原装纸箱中冷藏至2°C至8°C(36°F至46°F),以防止光照直至使用时间。不要冻结。 别摇了。ILUMYA可以在原始纸箱中在25°C(77°F)的室温下保存30天,以防光照。一旦储存在室温下,不要放回去
产地国家:美国
处 方 药:是
所属类别:1毫升 100毫克/毫升支
包装规格:1毫升 100毫克/毫升支
计价单位:盒
生产厂家中文参考译名:
Sun Pharma
生产厂家英文名:
Sun Pharma
原产地英文商品名:
ILUMYA injection 1mL 100mg/mL/syringe
原产地英文药品名:
tildrakizumab-asmn
中文参考商品译名:
ILUMYA预装注射器 1毫升 100毫克/毫升支
中文参考药品译名:
tildrakizumab-asmn
简介:
近日,美国FDA批准新药ILUMYA(tildrakizumab-asmn)上市,治疗适合接受全身治疗或光疗的中度至重度斑块型银屑病成人患者。
银屑病是皮肤上出现的慢性免疫性疾病。它是一种非传染性疾病,可加速皮肤细胞的生长周期,并导致皮肤出现厚厚的鳞屑区域。最常见的银屑病形式为斑块型银屑病,影响了大约80%至90%的银屑病患者。斑块型银屑病通常表现为红色、凸起的皮肤区域覆盖有片状白色鳞片,可能会发痒、疼痛,并可能导致裂开和流血。许多患者需要持续生活在这种疾病带来的痛苦中,他们急需有效的治疗来缓解疾病,提高生活质量。
ILUMYA正是这样一款疗法。它可以选择性结合IL-23的p19亚基,并抑制其与IL-23受体作用,从而抑制促炎细胞因子和趋化因子的释放。在完成初始剂量的第0周和第4周,ILUMYA每12周通过皮下注射以100mg的剂量施用。ILUMYA不适合对tildrakizumab严重过敏的患者。
批准日期:2018年3月21日 公司:Sun Pharma
ILUMYA(tildrakizumab-asmn)注射液,用于皮下使用
作用机制
Tildrakizumab是人源化IgG1/k单克隆抗体,其选择性结合IL-23的p19亚基并抑制其与IL-23受体的相互作用。IL-23是天然存在的细胞因子,其参与炎症和免疫应答。Tildrakizumab抑制促炎细胞因子和趋化因子的释放。
适应症和用法
ILUMYA是一种白细胞介素-23拮抗剂,用于治疗中度至重度斑块状银屑病的成人,这些斑块状银屑病是全身治疗或光疗的候选者。
剂量和给药
•通过皮下注射给药。
•推荐剂量为第0周,第4周和每12周一次100毫克。
剂量形式和强度
注射:在单剂量预填充注射器中的100mg/mL溶液。
禁忌症
对tildrakizumab或任何接受者的严重超敏反应。
警告和注意事项
•过敏反应:如果发生严重的过敏反应,立即停用ILUMYA并开始适当的治疗。
•感染:ILUMYA可能会增加感染的风险。如果出现临床上重要的慢性或急性感染的体征或症状,请指导患者就医。如果严重感染发展,请考虑停止ILUMYA直至感染消退。
•结核病(TB):在开始治疗前评估结核病。
不良反应
最常见(≥1%)与ILUMYA相关的不良反应
治疗是上呼吸道感染,注射部位反应和腹泻。
要报告可疑的不良反应,请联系Sun
Pharmaceutical Industries,Inc。,1-800-818-4555或FDA,1-800-FDA-1088或www.fda.gov/medwatch。
药物相互作用
活疫苗:在使用ILUMYA治疗的患者中避免使用活疫苗。
包装提供/存储和处理
如何提供
ILUMYA(tildrakizumab-asmn)注射液是一种无菌,无防腐剂,透明至微乳白色,无色至微黄色溶液。ILUMYA作为一个单剂量预填充注射器提供,每个载体提供1mL 100mg/mL溶液。
•NDC 47335-177-95
每个预装注射器都配有被动针头护套和针头盖。
存储和处理
在原装纸箱中冷藏至2°C至8°C(36°F至46°F),以防止光照直至使用时间。不要冻结。 别摇了。ILUMYA可以在原始纸箱中在25°C(77°F)的室温下保存30天,以防光照。一旦储存在室温下,不要放回去
用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 预装注射器ILUMYA injection 1mL 100mg(tildrakizumab-asmn )说明书
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 预装注射器ILUMYA injection 1mL 100mg(tildrakizumab-asmn )说明书