伊洛前列素注射液(Iloprost)-伊洛前列素说明书-Ilomedin Inf Konz 20mcg/ml i.v.1ampoule X 1ml
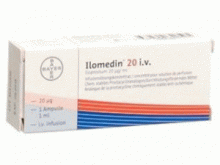 产地国家:瑞士
处 方 药:是
所属类别:20微克/毫升 1安瓿X1毫升
包装规格:20微克/毫升 1安瓿X1毫升
计价单位:盒
生产厂家中文参考译名:
拜耳
生产厂家英文名:
Bayer(Schweiz)AG
原产地英文商品名:
Ilomedin Infusionskonzentrat 20mcg/ml i.v. Ampullen 1ml
原产地英文药品名:
Iloprost
中文参考商品译名:
Ilomedin 20微克/毫升 1安瓿X1毫升
中文参考药品译名:
伊洛前列素
产地国家:瑞士
处 方 药:是
所属类别:20微克/毫升 1安瓿X1毫升
包装规格:20微克/毫升 1安瓿X1毫升
计价单位:盒
生产厂家中文参考译名:
拜耳
生产厂家英文名:
Bayer(Schweiz)AG
原产地英文商品名:
Ilomedin Infusionskonzentrat 20mcg/ml i.v. Ampullen 1ml
原产地英文药品名:
Iloprost
中文参考商品译名:
Ilomedin 20微克/毫升 1安瓿X1毫升
中文参考药品译名:
伊洛前列素
简介:
部份中文伊洛前列素处方资料(仅供参考) 英文名:Iloprost 商品名:Ilomedin® 中文名:伊洛前列素注射液 生产商:拜耳 药品分类 循环系统药物、抗血栓药物、其他抗凝抗栓剂 药理作用 本药是依前列醇的同类物,为血小板活化的强抑制剂,能抑制血小板凝集而使血栓形成受到削弱。本药可通过血小板受体激活腺苷酸环化酶,影响磷酯酶的活性和细胞液钙浓度,降低外周血管阻力、平均动脉压以及增加心率、心脏指数和肾血流量,促进尿钠排泄。 另外,本药还具有保护细胞、心功能以及抗心律失常作用。据国外资料报道,本药与前列环素比较,化学和生物学稳定性更高,可产生相似或更强的抗血小板效应。本药抗血小板的机制表现为激活腺苷酸环化酶,从而增加细胞内的环磷腺苷(cAMP)水平,有报道称本药升高细胞内cAMP的作用是前列环素的10倍。另外,对于伴有周围动脉闭塞的2型糖尿病患者,输入本药可降低其血浆内的纤溶酶原激活剂抑制因子1(PAI-1)的活性。PAI-1可使组织型纤维蛋白溶酶原激活剂和尿激酶型血浆素原激活剂失活,是一种有力的纤维蛋白溶解酶抑制剂。 适应症 1.用于防治周围血管血栓形成和栓塞,如心肌梗死、闭塞性血栓性脉管炎等。 2.肝素诱导性血小板减少症。 3.动力性肺动脉高压。 用法用量 成人静脉滴注 外周血管病:间歇滴注小于或等于2ng/(kg·min),每次持续滴注5~12h,连续3~6d或持续滴注14~48h。 对雷诺综合征患者严重缺血时,可连续用药14~28天。 肾功能不全时剂量 开始剂量应为0.5ng/(kg·min),然后以0.5ng/(kg·min)逐渐增量,直至出现轻微头痛和发热为止。 肝功能不全时剂量 见肾功能不全时剂量。成人静脉给药 为了避免或减少不良反应的发生,开始时应以低速度输入0.5ng/(kg·min),然后逐渐递增至最大剂量。 1.周围血管疾病和糖尿病性血管病:每天以2ng/(kg·min)或更小的速度输注6h,连续14~28d会起效。 2.伴有系统性硬化病的雷诺病:每天以0.5~3ng/(kg·min)的速度输注5~8h,并连续使用3d。 据报道,0.5ng/(kg·min)和标准剂量2ng/(kg·min)治疗的效果相同,但不良反应明显较少。 3.肝素诱发的血小板减少症:应用肝素前,静脉输入本药3~36ng/(kg·min)能有效地抑制肝素引起的血小板聚集,从而使急诊心血管手术能够进行。 药物相互作用 1.与吗多明合用,可增强抑制血小板聚集的作用。 2.长期每天输入本药对地高辛的曲线下面积、清除率或谷浓度无显著影响。 禁忌症 1.对本药过敏者; 2.孕妇。 注意事项 1.慎用 (1)肝功能障碍; (2)低血压; (3)老年人。 2.药物对哺乳的影响 尚不明确。 3.用药前后及用药时应当检查或监测 用药期间密切监测血压、心率。 不良反应 常有发热和头痛,其次为胃肠道反应,如恶心、呕吐、腹痛和腹泻。这些不良反应的个体差异很大,但都与剂量相关。停药后,不良反应即迅速缓解 英文说明书: Ilomedin Infusionskonzentrat 20mcg/ml i.v. Ampullen 1ml Fachinformationen Zusammensetzung Wirkstoff: Iloprostum ut Iloprosti trometamolum. Hilfsstoffe: Natrii chloridum, Ethanolum, Trometamolum, Acidum hydrochloridum, Aqua ad iniectabilia q.s. ad solutionem. Galenische Form und Wirkstoffmenge pro Einheit Konzentrat zur Herstellung einer Infusionslösung. Ilomedin 20 i.v.: Ampullen mit 20 µg Iloprostum pro 1 ml. Ilomedin 50 i.v.: Ampullen mit 50 µg Iloprostum pro 2,5 ml. Indikationen/Anwendungsmöglichkeiten Fortgeschrittene Thrombangiitis obliterans (Buerger-Krankheit) mit schweren Durchblutungsstörungen in Fällen, bei denen eine Revaskularisierung nicht angezeigt ist. Ilomedin 20/50 i.v. kann zudem angewendet werden: In seltenen Fällen von fortgeschrittenem sekundären Morbus Raynaud, der auf andere Therapien nicht anspricht. Dosierung/Anwendung Vor Beginn einer Behandlung bei Frauen ist eine Schwangerschaft auszuschliessen (siehe auch Rubrik «Warnhinweise und Vorsichtsmassnahmen»). Die Behandlung mit Ilomedin 20/50 i.v. soll nur in Krankenhäusern oder in Arztpraxen mit entsprechender klinischer Ausstattung erfolgen. Übliche Dosierung: Die Behandlung mit Ilomedin 20/50 i.v. erfolgt als intravenöse Infusion, und Ilomedin 20/50 i.v. wird entweder über eine periphere Vene oder einen zentralen Venenkatheter mittels einer Infusionsschlauchpumpe oder einer Infusionsspritzenpumpe infundiert. Für die Verabreichung mit einer Infusionsschlauchpumpe (z.B. vom Typ Infusomat®) muss Ilomedin 20/50 i.v. auf eine Konzentration von 0,2 µg/ml verdünnt werden. Bei Applikation mit einer Infusionsspritzenpumpe (z.B. vom Typ Perfusor®) erfolgt eine Verdünnung auf eine Konzentration von 2 µg/ml. Zubereitung der verdünnten gebrauchsfertigen Infusionslösungen vgl. Rubrik «Sonstige Hinweise/Hinweise für die Handhabung». Die Dosis richtet sich nach individueller Verträglichkeit und liegt zwischen 0,5–2,0 ng Iloprost/kg Körpergewicht/Min über 6 Stunden täglich. Weiter unten wird die Ermittlung der individuell verträglichen Dosis beschrieben. Blutdruck und Herzfrequenz müssen zu Beginn der Infusion und bei jeder Dosiserhöhung gemessen werden. Sollten während der Infusion Nebenwirkungen wie Kopfschmerzen, Übelkeit oder unerwünschter Blutdruckabfall auftreten, wird die lnfusionsgeschwindigkeit auf die verträgliche Dosisstufe reduziert. Bei schwerwiegenden Nebenwirkungen wird die Infusion unterbrochen. Die Behandlung wird mit der in den ersten 2–3 Tagen ermittelten verträglichen Dosis in der Regel über 4 Wochen fortgesetzt. Beim Raynaud-Syndrom reichen für eine Besserung über mehrere Wochen häufig kürzere Behandlungszeiten (3–5 Tage) aus (vgl. Rubrik «Warnhinweise und Vorsichtsmassnahmen»). Eine Dauerinfusion über mehrere Tage ist wegen der möglichen Entwicklung einer Tachyphylaxie der Thrombozytenwirkung und einer möglichen Rebound-Hyperaggregabilität der Thrombozyten nach Beendigung der Behandlung nicht zu empfehlen, obwohl bisher keine klinischen Komplikationen im Zusammenhang mit diesen Phänomenen berichtet worden sind. Ilomedin 20/50 i.v. Ampullen niemals unverdünnt anwenden (Gefahr eines Kreislaufschocks)! Haut- oder Schleimhautkontakt mit Iloprost sowie paravenöse Infusion sind unbedingt zu vermeiden (siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen»), da rasch ein Erythem auftreten kann. An den ersten 2–3 Tagen wird die individuell verträgliche Dosis ermittelt. Zu diesem Zweck sollte die Behandlung mit einer Infusionsgeschwindigkeit von 0.5 ng/kg/min während 30 Minuten begonnen werden. Danach wird die Dosis in etwa 30-minütigen Intervallen schrittweise um jeweils 0.5 ng/kg/min bis auf maximal 2.0 ng/kg/min erhöht. Dosierungstabelle für Verabreichung mittels Infusionsschlauchpumpe (Konzentration 0,2 µg/ml) Dosierungstabelle für Verabreichung mittels Infusionsspritzenpumpe (Konzentration 2 µg/ml) Spezielle Dosierungsanweisungen Bei Patienten mit Nieren- oder Leberinsuffizienz (inkl. Dialyse) sollte die initiale Dosis von Ilomedin 20/50 i.v. aufgrund der Möglichkeit einer reduzierten Clearance auf 0,25 ng/kg/min (entspricht 50% der üblichen Anfangsdosis) vermindert werden. Dann ganz langsame Steigerung, maximal bis auf 1 ng/kg/min, was 50% der üblichen Maximaldosis entspricht. Zurzeit liegen nur vereinzelte Berichte über die Anwendung bei Kindern und Jugendlichen vor. Kontraindikationen Überempfindlichkeit gegenüber Iloprost oder einem der Hilfsstoffe gemäss Zusammensetzung. Schwangerschaft, Stillzeit (siehe auch Rubrik «Schwangerschaft/Stillzeit»). Situationen, in denen die Wirkung von Ilomedin 20/50 i.v. auf die Thrombozyten das Blutungsrisiko erhöhen könnte (z.B. florides Magengeschwür, Polytrauma, intrakranielle Blutungen). Schwere koronare Herzkrankheit bzw. instabile Angina pectoris. Zustand nach Myokardinfarkt innerhalb der letzten sechs Monate. Akute oder chronische Herzinsuffizienz (NYHA II–IV). Prognostisch relevante Herzrhythmusstörungen. Verdacht auf Lungenstauung. Warnhinweise und Vorsichtsmassnahmen Eine dringend indizierte Amputation (z.B. bei infizierter Gangrän) sollte nicht zugunsten eines Behandlungsversuchs mit Ilomedin 20/50 i.v. zurückgestellt werden. Der Patient ist nachdrücklich anzuhalten, das Rauchen einzustellen. Bei arterieller Hypotonie ist die Indikation streng zu stellen und vorsichtig zu dosieren (siehe Rubrik «Unerwünschte Wirkungen»). Patienten mit ernsthaften Herzerkrankungen sollten ebenfalls streng überwacht werden. Zu Beginn der Infusion und nach jeder Dosissteigerung sind Blutdruck- und Herzfrequenzkontrollen erforderlich. Die Möglichkeit einer orthostatischen Hypotonie bei Aufrichten des Patienten nach der Infusion sollte bedacht werden. Bei Patienten mit zerebrovaskulärem Insult (z.B. transitorische ischämische Attacke, Schlaganfall) innerhalb der letzten drei Monate sind Nutzen und Risiko sorgfältig gegeneinander abzuwägen (vgl. auch Rubrik «Kontraindikationen»). Die paravenöse Infusion von unverdünntem Ilomedin 20/50 i.v. kann zu lokalen Veränderungen an der Einstichstelle führen. Die orale Einnahme und der Kontakt mit Haut oder Schleimhäuten sind unbedingt zu vermeiden. Bei Hautkontakt kann llomedin 20/50 langdauernde, schmerzlose Erytheme erzeugen. Daher sind geeignete Vorsichtsmassnahmen zu treffen, um Hautkontakt zu vermeiden. Sollte Ilomedin 20/50 i.v. auf die Haut gelangen, ist die betroffene Stelle sofort mit reichlich Wasser oder physiologischer Kochsalzlösung zu spülen. Interaktionen In pharmakologischen Experimenten zeigte lloprost eine Verstärkung der blutdrucksenkenden Wirkung von β-Rezeptorenblockern, Calciumantagonisten und Vasodilatatoren sowie einen potenzierenden Effekt auf die blutdrucksenkende Wirkung von ACE-Inhibitoren. Die gleichzeitige Anwendung von Diuretika könnte das hypotensive Potential von Iloprost verstärken. Dies liess sich bei Freiwilligen jedoch nicht nachweisen. Bei starker Blutdrucksenkung sollte die Infusionsgeschwindigkeit reduziert werden. Bei Vorbehandlung mit Glukokortikoiden wird im Tierexperiment die vasodilatierende Wirkung von Ilomedin 20/50 i.v. abgeschwächt, während die thrombozytenaggregationshemmende Wirkung unbeeinflusst bleibt. Die Bedeutung dieses Befundes für die Anwendung am Menschen ist nicht bekannt. Da Iloprost die Plättchenaggregation hemmt, kann theoretisch eine gleichzeitige Gabe von Heparin, Cumarinderivaten oder anderen Thrombozytenaggregationshemmern (wie Acetylsalicylsäure, nicht steroidale Antiphlogistika, Phosphodiesterasehemmer und Nitrovasodilatatoren, z.B. Molsidomin) das Blutungsrisiko erhöhen. Beim Auftreten von Blutungen ist die Infusion von Iloprost abzubrechen. Die orale Prämedikation mit Acetylsalicylsäure in einer Dosierung von bis zu 300 mg/Tag über einen Zeitraum von acht Tagen hatte keinen Einfluss auf die Pharmakokinetik von Iloprost. Die Ergebnisse von Studien am Menschen haben gezeigt, dass Iloprost-Infusionen keinen Einfluss auf die Pharmakokinetik oraler Mehrfachdosen von Digoxin bei Patienten haben. Darüber hinaus hat Iloprost keinerlei Auswirkungen auf die Pharmakokinetik von t-PA als Begleitmedikation. Auch wenn noch keine klinischen Studien durchgeführt wurden, zeigten In-vitro-Studien zur Untersuchung des Zytochrom-P450-Enzyme hemmenden Potenzials von Iloprost, dass keine relevante Hemmung des Wirkstoffmetabolismus über dieses Enzymsystem durch Iloprost zu erwarten ist. Wechselwirkungen mit anderen Arzneistoffen auf der Ebene der Plasmaproteinbindung sind unwahrscheinlich, da Iloprost ganz überwiegend an das Albumin des Blutplasmas gebunden vorliegt (Proteinbindung: 60%) und in Abhängigkeit der verabreichten Dosis (siehe «Pharmakokinetik») nur sehr niedrige Iloprost-Konzentrationen erreicht werden. Schwangerschaft/Stillzeit Schwangerschaft Studien bei Tieren haben eine Schädigung des Fötus gezeigt. Das potenzielle Risiko der therapeutischen Anwendung von Iloprost in der Schwangerschaft ist nicht bekannt. Ilomedin 20/50 i.v. ist für schwangere Frauen oder für Frauen, die schwanger werden könnten, kontraindiziert. Vor Beginn einer Behandlung mit llomedin 20/50 ist bei Frauen im gebärfähigen Alter eine Schwangerschaft auszuschliessen, während der Therapie ist von ihnen eine wirksame Methode der Antikonzeption anzuwenden. Stillzeit Es ist nicht bekannt, ob Iloprost in die Muttermilch übergeht. Da Iloprost in äusserst geringer Konzentration in die Muttermilch von Ratten übergeht, darf Iloprost in der Stillzeit nicht verabreicht werden. Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen Nicht zutreffend. Unerwünschte Wirkungen Die häufigsten unerwünschten Nebenwirkungen (≥10%), die bei Patienten in klinischen Studien mit Iloprost beobachtet werden, sind Kopfschmerzen, Flushing, Nausea, Erbrechen und Hyperhidrose. Diese sind bei der Dosistitration zu Beginn der Behandlung zu erwarten, bei der die für den einzelnen Patienten am besten verträgliche Dosis ermittelt wird. Die Nebenwirkungen klingen jedoch bei einer Dosissenkung gewöhnlich rasch ab. Die schwerwiegendsten unerwünschten Ereignisse bei Patienten, welche Iloprost erhalten, sind gesamthaft gesehen zerebrovaskulärer Insult, Myokardinfarkt, Lungenembolie, Herzversagen, Konvulsion, Hypotension, Tachykardie, Asthma, Angina pectoris, Dyspnoe und Lungenödem. Andere Nebenwirkungen betreffen lokale Reaktionen an der Infusionsstelle. So können zum Beispiel Rötungen oder Schmerzen an der Infusionsstelle auftreten, oder es kann bei kutaner Vasodilatation zu einem streifigen Erythem oberhalb der Infusionsvene kommen. Die unten aufgeführten Nebenwirkungen mit Ilomedin 20/50 i.v sind nach Organklassen aufgelistet. Zur Beschreibung einer gewissen Reaktion und deren Synonyme und Begleiterscheinungen wurde der am besten passende MedDRA-Term verwendet. Die Häufigkeitsangaben der unerwünschten Wirkungen sind nach folgender Einteilung aufgeführt: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten(≥1/10’000, <1/1000) und sehr selten (<1/10’000). Das gesamte Sicherheitsprofil von Ilomedin 20/50 i.v. basiert auf Daten nach Markteinführung und auf gepoolten Daten aus klinischen Studien. Die rohe Inzidenz basiert auf den kumulativen Daten von 3325 Patienten, im Allgemeinen älteren und multimorbiden Patienten mit peripherer arterieller Verschlusskrankheit (PAVK) in den fortgeschrittenen Stadien III und IV sowie von Patienten mit Thrombangiitis obliterans (TAO), die Iloprost entweder im Rahmen kontrollierter oder unkontrollierter klinischer Studien oder eines Compassionate-Use-Programms erhielten. Erkrankungen des Blutes und des Lymphsystems Gelegentlich: Thrombozytopenie. Immunsystem Gelegentlich: Überempfindlichkeit. Stoffwechsel- und Ernährungsstörungen Häufig: verminderter Appetit. Psychiatrische Störungen Häufig: Apathie, verwirrter Zustand. Gelegentlich: innere Unruhe, Depression, Halluzination. Nervensystem Sehr häufig: Kopfschmerzen (68.8%). Häufig: Schwindel/Vertigo, Parästhesie, Klopfgefühl, Hyperästhesie, Brennen, Unruhe, Agitiertheit, Sedation, Benommenheit. Gelegentlich: Konvulsion*, Synkope, Tremor, Migräne. Augen Gelegentlich: verschwommenes Sehen, Augenirritation, Augenschmerzen. Ohr und Innenohr Selten: Störungen des Vestibulums. Herz Häufig: Tachykardie*, Bradykardie, Angina pectoris*. Gelegentlich: Myokardinfarkt*, Herzversagen*, Arrhythmie, Extrasystolen. Iloprost kann, insbesondere bei Patienten mit koronarer Arterienkrankheit, Angina pectoris auslösen. Gefässe Sehr häufig: Flushing (58.0%). Häufig: Hypotonie*, erhöhter Blutdruck. Gelegentlich: zerebrovaskulärer Insult*, zerebrale Ischämie, Lungenembolie*, tiefe Venenthrombose. Das Auftreten von Hypotonie bei geringen Dosierungen von Iloprost wurde berichtet. Atmungsorgane Häufig: Dyspnoe*. Gelegentlich: Asthma*, Lungenödem*. Selten: Husten. Gastrointestinale Störungen Sehr häufig: Übelkeit (40%), Erbrechen (24%). Häufig: Diarrhoe, abdominelle Beschwerden, Bauchschmerzen. Gelegentlich: hämorrhagische Diarrhoe, Rektumhämorrhagie, Dyspepsie, rektaler Tenesmus, Obstipation, Eruktation, Dysphagie, trockener Mund, Dysgeusie. Selten: Proktitis. Leber und Galle Gelegentlich: Ikterus. Haut Sehr häufig: Hyperhidrose (14%). Gelegentlich: Pruritus. Muskelskelettsystem Häufig: Kieferschmerzen, Trismus, Myalgie, Arthralgie. Gelegentlich: Tetanie, Muskelspasmen, Hypertonie. Nieren und Harnwege Gelegentlich: Nierenschmerzen, Tenesmus vesicae, Urinanomalien, Dysurie, Harnwegserkrankung. Allgemeine Störungen und Reaktionen an der Applikationsstelle Häufig: Schmerzen, Pyrexie/erhöhte Körpertemperatur, Hitzegefühl, Asthenie, Unwohlsein, Schüttelfrost, Erschöpfung/Müdigkeit, Durst, Reaktionen an der Infusionsstelle (Erythem an der Infusionsstelle, Schmerzen an der Infusionsstelle, Phlebitis an der Infusionsstelle). * Lebensbedrohende Zustände und/oder Todesfälle wurden berichtet. Überdosierung Symptome: Starke Gesichtsrötung und schwere Kopfschmerzen, möglicherweise Glieder- oder Rückenschmerzen. Vasovagale Reaktionen mit plötzlich eintretender Blässe, Schweissausbruch, Übelkeit, Erbrechen, krampfartigen abdominellen Schmerzen, Durchfall, Blutdruckabfall oder auch Blutdruckanstieg, Bradykardie oder Tachykardie. Therapie: Ein spezifisches Antidot ist nicht bekannt. Bei Überdosierung sind die Infusion abzubrechen und symptomatische Massnahmen einzuleiten. Eigenschaften/Wirkungen ATC-Code: B01AC11 Iloprost ist ein synthetisches Prostazyklin (PGI2)-Derivat. Seine pharmakologischen Eigenschaften von synthetischen Iloprost entsprechen weitgehend denen des natürlichen Prostazyklins (PGI2). Die folgenden pharmakologischen Effekte wurden beobachtet: Hemmung der Thrombozyten-Aggregation, Adhäsion und Freisetzungsreaktion der Thrombozyten; Dilatation von Arteriolen und Venolen; Erhöhung der Kapillardichte und Verminderung der gesteigerten Gefässpermeabilität in der Mikrozirkulation; Stimulierung des endogenen fibrinolytischen Potenzials; entzündungshemmende Wirkungen wie Inhibition der Leukozytenadhäsion nach Endothelläsion und der Leukozytenakkumulation in verletztem Gewebe sowie verminderte Freisetzung des Tumornekrosefaktors. llomedin 20/50 fördert die Abheilung ischämiebedingter Ulzerationen und vermindert die Schmerzen bei schweren chronischen arteriellen Durchblutungsstörungen. Pharmakokinetik Distribution Bereits 10–20 Minuten nach Beginn einer intravenösen Infusion stellt sich ein Gleichgewicht von Zufuhr und metabolischer Inaktivierung von lloprost ein. Die Höhe des konstanten Plasmaspiegels hängt linear von der pro Zeiteinheit zugeführten Dosis ab. Bei der Infusion von 3 ng/kg/min sind Plasmaspiegel von 135 ± 24 pg/ml zu erwarten. Die Plasmaproteinbindung beträgt 60%, vornehmlich an Albumin. Das Verteilungsvolumen liegt in der terminalen Phase bei 0,7l/kg. Metabolismus Iloprost wird vornehmlich über die β-Oxidation der Carboxylseitenkette metabolisiert, hauptsächlich in der Leber. Unveränderter Wirkstoff wird nicht wieder ausgeschieden. Der Hauptmetabolit ist das Tetranoriloprost, das in vier Diastereoisomeren in freier und konjugierter Form im Harn gefunden wird. Tetranoriloprost ist pharmakologisch inaktiv wie in Tierversuchen gezeigt wurde. In-vitro-Studien deuten darauf hin, dass der Stoffwechsel von Iloprost in der Lunge nach intravenöser Verabreichung oder nach Inhalation vergleichbar ist. Elimination Bei Probanden mit normaler Nieren- und Leberfunktion verläuft der Abbau von Iloprost nach intravenöser Infusion in den meisten Fällen zweiphasig mit mittleren Halbwertzeiten von 3 bis 5 Minuten und 15 bis 30 Minuten. Bereits zwei Stunden nach Infusionsende ist deshalb der Wirkstoffspiegel auf weniger als 10% der Gleichgewichtskonzentration abgesunken. Die Iloprost-Gesamtclearance beträgt etwa 20 ml/kg/min, was darauf hindeutet, dass die Verstoffwechslung von Iloprost auch ausserhalb der Leber stattfindet. Anhand der Anwendung von 3H-Iloprost bei gesunden Probanden wurde eine Untersuchung zur Massenbilanz durchgeführt. Nach intravenöser Infusion beträgt die Rückgewinnungsrate der Gesamtradioaktivität 81%. Die entsprechende Rückgewinnungsrate im Urin und in den Fäzes liegt bei 68% bzw. 12%. Die Elimination der Metabolite aus Plasma und mit dem Urin erfolgt jeweils in zwei Phasen, für die Halbwertszeiten von etwa 2 und 5 Stunden (Plasma) bzw. 2 und 18 Stunden (Harn) berechnet wurden. Kinetik spezieller Patientengruppen Eingeschränkte Nierenfunktion: In Rahmen einer Studie mit intravenöser Iloprost-Infusion zeigte sich, dass die Clearance bei Patienten mit terminaler Niereninsuffizienz unter intermittierender Dialysebehandlung signifikant niedriger ist (Mittlere CL = 5 ± 2 ml/kg/min) als bei Patienten mit Niereninsuffizienz, die keine intermittierende Dialysebehandlung erhalten (Mittlere CL = 18±2 ml/kg/min). Eingeschränkte Leberfunktion: Da Iloprost weitgehend über die Leber abgebaut wird, werden die Plasmaspiegel des Wirkstoffs durch Veränderungen der Leberfunktion beeinflusst. Im Rahmen einer Studie zur intravenösen Verabreichung wurden Daten von acht Patienten mit Leberzirrhose erhoben. Die mittlere Iloprost-Clearance wird auf 10 ml/kg/min geschätzt. Alter und Geschlecht: Alter und Geschlecht sind für die Pharmakokinetik von Iloprost nicht von klinischer Relevanz. Präklinische Daten Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, chronischen Toxizität, Gentoxizität und zum kanzerogenen Potenzial lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Präklinische Effekte wurden nur nach Expositionen beobachtet, die ausreichend über der maximalen humantherapeutischen Exposition lagen. Die Relevanz für den Menschen wird als gering bewertet. Genotoxizität, kanzerogenes Potenzial In-vitro- und In-vivo-Studien zu genotoxischen Wirkungen ergaben keine Hinweise auf ein mutagenes Potenzial. Im Rahmen von Studien zum kanzerogenen Potenzial an Ratten und Mäusen wurde kein kanzerogenes Potenzial von Iloprost beobachtet. Reproduktionstoxikologie In Studien zur Embryo- und Fetotoxizität an Ratten führte die kontinuierliche intravenöse Iloprost-Verabreichung bei einigen Foeten/Jungtieren dosisunabhängig zu Anomalien einzelner Phalangen der Vorderpfoten. Diese Veränderungen stellen vermutlich keine teratogenen Wirkungen im engeren Sinne dar, sondern sind höchstwahrscheinlich auf die Iloprost-induzierte Wachstumsretardierung in der späten Phase der Organgenese aufgrund der hämodynamischen Veränderungen in der fetoplazentaren Einheit zurückzuführen. Vermutlich ist diese Wachstumsretardierung weitgehend reversibel und kann in der postnatalen Entwicklung kompensiert werden. Im Rahmen von vergleichenden Studien zur Embryotoxizität an Kaninchen und Affen wurden selbst nach erheblich höherer Dosierung, die die beim Menschen angewendete Dosis um ein Mehrfaches überschritt, weder derartige digitale noch andere grobstrukturelle Anomalien beobachtet. Sonstige Hinweise Inkompatibilitäten Das Infusionslösungskonzentrat darf nur mit den unter «Hinweise für die Handhabung» aufgeführten Arzneimitteln verdünnt werden und es dürfen der gebrauchsfertigen Infusionslösung keine anderen Wirkstoffe zugesetzt werden. Haltbarkeit Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden. Besondere Lagerungshinweise Bei Raumtemperatur (15–25 °C) und für Kinder unzugänglich aufbewahren. Hinweise für die Handhabung Zubereitung der Infusionslösung 0,2 µg/ml für die Verwendung mit einer Infusionsschlauchpumpe, z.B. Infusomat®: Der Inhalt einer Ampulle Ilomedin 50 i.v. zu 2,5 ml (entspricht 50 µg Iloprost) wird mit steriler physiologischer Kochsalzlösung oder einer 5%igen Glukoselösung auf ein Endvolumen von 250 ml Infusionslösung verdünnt. Der Inhalt einer Ampulle Ilomedin 20 i.v. zu 1 ml (entspricht 20 µg Iloprost) wird mit steriler physiologischer Kochsalzlösung oder einer 5%igen Glukoselösung auf ein Endvolumen von 100 ml Infusionslösung verdünnt. Zubereitung der Infusionslösung 2 µg/ml für die Verwendung mit einer Infusionsspritzenpumpe, z.B. Perfusor®: Der Inhalt einer Ampulle Ilomedin 50 i.v. zu 2,5 ml (entspricht 50 µg Iloprost) wird mit steriler physiologischer Kochsalzlösung oder 5%iger Glukoselösung auf ein Endvolumen von 25 ml Infusionslösung verdünnt. Der Inhalt einer Ampulle Ilomedin 20 i.v. zu 1 ml (entspricht 20 µg Iloprost) wird mit steriler physiologischer Kochsalzlösung oder 5%iger Glukoselösung auf ein Endvolumen von 10 ml Infusionslösung verdünnt. Um die Sterilität zu gewährleisten, ist die Infusionslösung jeden Tag frisch zuzubereiten. Der Inhalt der Ampulle ist gründlich mit dem Verdünnungsmittel zu mischen. Zulassungsnummer 50064 (Swissmedic). Zulassungsinhaberin Bayer (Schweiz) AG, Zürich.用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 伊洛前列素注射液(Iloprost)-伊洛前列素说明书-Ilomedin Inf Konz 20mcg/ml i.v.1ampoule X 1ml
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 伊洛前列素注射液(Iloprost)-伊洛前列素说明书-Ilomedin Inf Konz 20mcg/ml i.v.1ampoule X 1ml