 生物仿制药的批准是基于对生物仿制药和已经批准的参考药物在结构,功能,药代动力学,药效动力学以及临床疗效和安全性方面的高度相似性的严格证明。
生物仿制药的批准是基于对生物仿制药和已经批准的参考药物在结构,功能,药代动力学,药效动力学以及临床疗效和安全性方面的高度相似性的严格证明。
贝伐单抗-awwb与基于5-氟尿嘧啶的化学疗法联合用于转移性结直肠癌(mCRC)的一线或二线治疗;一线贝伐单抗治疗进展的患者,mCRC的二线治疗与氟嘧啶-奥沙利铂化疗联合使用;一线治疗不可切除,局部晚期,复发或转移性非鳞状非小细胞肺癌(NSCLC)联合卡铂和紫杉醇;胶质母细胞瘤(GBM)的二线治疗为单一疗法;合并紫杉醇和顺铂或紫杉醇和拓扑替康的持续,复发或转移性宫颈癌患者。未批准用于贝伐单抗的卵巢癌治疗。
在安全性方面,生物仿制药部门的3/4级不良事件(AE)发生率为42.9%,而参考药物为44.3%。总体而言,在不良事件,严重不良事件,死亡或治疗中止方面,在临床上没有有意义的差异。
对于mCRC患者,贝伐单抗-awwb的推荐剂量为每2周静脉推注5 mg / kg静脉推注剂量,每2周静脉给予10 mg / kg FOLFOX4剂量或5 mg kg静脉推注剂量氟嘧啶-伊立替康或氟嘧啶-奥沙利铂为基础的化疗方案,每2周给药一次或7.5毫克/千克静脉注射剂量,每3周给药一次。
对于非小细胞肺癌患者,应每3周以卡铂-紫杉醇联合用药15 mg / kg静脉注射贝伐单抗-awwb。对于GBM患者,应每3周给予10 mg / kg的静脉注射剂量;对于宫颈癌患者,建议每3周静脉注射15 mg / kg的剂量与紫杉醇-顺铂或紫杉醇-拓扑替康联合使用。
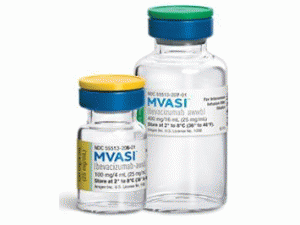
贝伐单抗-awwb,是由安进公司和过敏原公司以Mvasi的形式销售,成为去年秋天获得美国食品和药物管理局批准用于治疗癌症的首个此类药物。它是Genentech抗血管生成药物贝伐单抗(Avastin)的生物仿制药,贝伐单抗是针对血管内皮生长因子A(VEGF-A)的单克隆抗体。
虽然靶向疗法已经彻底改变了许多不同类型的癌症的治疗方法,并迎来了个性化医学的时代,可它们的价格却过高。但是随着针对肿瘤适应症开发的许多首批FDA批准的单克隆抗体的专利保护期满,其他公司也可以自行开发这些药物的版本,即生物仿制药。预计生物仿制药的价格将大大低于其所基于的原始药物,这将可以让更多的患者可以用较低的价格买到治疗药品。
用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 »
第一个生物仿制癌症药——bevacizumab-awwb贝伐单抗 生物仿制药的批准是基于对生物仿制药和已经批准的参考药物在结构,功能,药代动力学,药效动力学以及临床疗效和安全性方面的高度相似性的严格证明。
生物仿制药的批准是基于对生物仿制药和已经批准的参考药物在结构,功能,药代动力学,药效动力学以及临床疗效和安全性方面的高度相似性的严格证明。