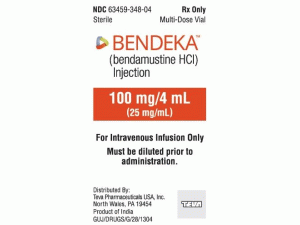
苯达莫司汀,苯达莫司汀冻干粉注射剂(Ribomustin Trockensubstanz 100mg)
 药店国别:无
产地国家:瑞士
处方药:是
所属类别: 100毫克/瓶
包装规格: 100毫克/瓶
计价单位:瓶
生产厂家中文参考译名:无
生产厂家英文名:Mundipharma
原产地英文商品名:Ribomustin Trockensubstanz 100mg/vial
原产地英文药品名:Bendamustine hydrochloridum
中文参考商品译名:Ribomustin冻干粉注射剂 100毫克/瓶
中文参考药品译名:盐酸苯达莫司汀
曾用名:无
药店国别:无
产地国家:瑞士
处方药:是
所属类别: 100毫克/瓶
包装规格: 100毫克/瓶
计价单位:瓶
生产厂家中文参考译名:无
生产厂家英文名:Mundipharma
原产地英文商品名:Ribomustin Trockensubstanz 100mg/vial
原产地英文药品名:Bendamustine hydrochloridum
中文参考商品译名:Ribomustin冻干粉注射剂 100毫克/瓶
中文参考药品译名:盐酸苯达莫司汀
曾用名:无
简介
部份中文盐酸苯达莫司汀处方资料(仅供参考) 苯达莫司汀(bendamustine,Treanda)用于慢性淋巴细胞性白血病(CLL)。盐酸苯达莫司汀最早于19世纪60年代初期由Ozegowski和其同事在德国耶拿的微生物试验协会研制。合成的目的是使一种烷基化氮芥(一种非功能烷化剂)连接一个嘌呤和氨基酸。 新合成的化合物与苯丁酸氮芥相比主要的优点是它的水溶性。苯达莫司汀从1971年到1992年以Cytostasan的商品名由耶拿制药公司生产。 英文名:Bendamustine 中文名:盐酸苯达莫司汀 适应症: 1.慢性淋巴细胞白血病(CLL)。不同于苯丁酸氮芥的一线疗法的疗效尚未确立。 2.在利妥昔单抗(rituximab,美罗华)或含利妥昔单抗方案治疗过程中,或者治疗6个月内,病情仍然进展的惰性B细胞非霍奇金淋巴瘤(NHL)患者。 作用机理 本品是一种双功能基烷化剂,可以导致DNA单链和双链通过烷化作用交联,打乱DNA 的功能和DNA的合成,使DNA和蛋白之间,以及蛋白和蛋白之间产生交联,从而发挥抗肿瘤作用。 剂量及用药:该药储存温度不应超过30℃,避光保存,使用前临时配制。 配制流程: 该药每100mg须先溶于20ml无菌注射用水,充分振摇直到完全溶解成澄清、无色或淡黄色溶液,溶解时间一般不超过5分钟,溶解后浓度为5mg/ml。在溶解后30分钟之内,根据需要抽取适量苯达莫司汀水溶液,转移至500ml氯化钠注射液(0.9%)或葡萄糖氯化钠注射液(2.5%/0.45%)中,并确保苯达莫司汀在注射液中的最终浓度在0.2~0.6mg/ml之间。配制好的注射液可在2~8℃冷藏保存24小时,或在室温及自然光下保存3小时。 苯达莫司汀治疗CLL时,以28天为一个治疗周期,一般需要6个治疗周期。在每个治疗周期的第一天和第二天给药,推荐剂量为100mg/m2。该药经静脉滴注给药,每次给药时间不应少于30分钟。 苯达莫司汀治疗NHL时,以21天为一个治疗周期,一般需要8个治疗周期。在每个治疗周期的第一天和第二天给药,推荐剂量为120mg/m2。每次给药时间不应少于60分钟。 特点 ①疗效确切,能明显降低复发率与死亡率,且不良反应小,安全性好,起效迅速,作用持久; ②本品在31至84岁人群中的药代动力学指标(AUC和Cmax)显示:65周岁以上或以下患者之间没有明显区别; ③在儿童患者上的有效性虽尚未建立。但通过白血病儿童患者的I、II期临床试验评估,其安全性与成人体内基本相似; ④随着深入临床研究,未来可能扩大到儿童用药; ⑤R-CHOP方案(环磷酰胺、多柔比星、长春新碱、泼尼松加利妥昔单抗)是目前晚期惰性淋巴瘤和套细胞淋巴瘤老年患者的一线标准治疗。 苯达莫司汀单药治疗利妥昔单抗耐药的B细胞惰性淋巴瘤可提高疗效,且耐受性良好。研究发现苯达莫司汀联合利妥昔单抗较之传统R-CHOP更有效且毒性更小,耐受性更好。《柳叶刀》杂志的一项研究,苯达莫司汀联合利妥昔单抗治疗方案可以替代标准治疗,用于新诊断的惰性非霍奇金淋巴瘤(NHL)和套细胞淋巴瘤(MCL)患者。 禁忌症:对盐酸苯达莫司汀及甘露醇过敏者禁用。 药物相互作用 与CYP1A2抑制剂(如氟伏沙明,环丙沙星等)合用时,有可能会升高苯达莫司汀血浓度,并使其代谢物M3和M4浓度降低;与CYP1A2诱导剂(如奥美拉唑,抽烟等)合用时,有可能会降低苯达莫司汀血浓度,并使其代谢物M3和M4浓度升高。 不良反应 苯达莫司汀常见不良反应包括恶心、呕吐、腹泻、疲乏、虚弱、皮疹、搔痒、一些感染症状和体征(如持续咽喉疼痛、发热和寒战)、容易碰伤/出血以及口腔溃疡等;严重不良反应可能还有骨髓抑制、肿瘤溶解综合征等。苯达莫司汀可能引起轻微或严重过敏反应,患者在给药过程中或给药后初期可能出现皮疹、面部肿胀、呼吸困难等过敏症状。 苯达莫司汀可能对胎儿造成影响,因此,女性治疗过程中及治疗后3个月内,应采取适当避孕措施及停止哺乳。 患者咨询用药前应告知主诊医生有关过敏史、详细的用药史及其他伴发疾病,特别是血液/骨髓病、肾脏病、肝病、感染疾病等,同时应与医生详细讨论服药的风险及受益情况,避免与其他可能产生不良相互作用的药物合用。 该药可能使现有感染加重,因此,在未征得医生同意前,患者不要自行进行疫苗接种;同时应避免与近期口服过脊髓灰质炎疫苗或通过鼻吸入给予流感疫苗的人群,又或者是其他传染病(如水痘、流感)患者接触.英文版说明
Ribomustin Trockensubstanz 100mg DurchstechflascheFachinformationenZusammensetzungWirkstoff: Bendamustini hydrochloridum.Hilfsstoffe: Mannitolum.Galenische Form und Wirkstoffmenge pro EinheitLyophilisat für Infusionslösung.Durchstechflaschen zu 25 mg und 100 mg Bendamustinhydrochlorid.Indikationen/AnwendungsmöglichkeitenChronische lymphatische Leukämie.Follikuläres Non-Hodgkin-Lymphom in der Erstlinientherapie in Kombination mit Rituximab.Follikuläres Non-Hodgkin-Lymphom bei Patienten mit Progression während oder innerhalb von 6 Monaten nach Behandlung mit Rituximab oder einer Rituximab-enthaltenden Therapie. Es liegen keine klinischen Studien zur Behandlung eines Rezidivs nach 6 Monaten vor.Dosierung/AnwendungEine Therapie mit Ribomustin sollte nur unter Aufsicht eines erfahrenen Onkologen durchgeführt werden.Ribomustin wird nach Herstellung der Lösung als i.v. Kurzzeitinfusion über 30–60 min verabreicht.Chronische lymphatische LeukämieDie Dosierung beträgt 100 mg/m² Körperoberfläche Ribomustin i.v. an den Tagen 1 und 2; Wiederholung alle 4 Wochen.Follikuläres Non-Hodgkin-LymphomKombination mit RituximabDie Dosierung beträgt 90 mg/m² Körperoberfläche Ribomustin i.v. an den Tagen 1 und 2 plus 375 mg/m² Rituximab i.v. an Tag 1; Wiederholung alle 4 Wochen.MonotherapieDie Dosierung beträgt 120 mg/m² Körperoberfläche Ribomustin i.v. an den Tagen 1 und 2; Wiederholung alle 3 Wochen. Dosisreduktionen oder Dosisverzögerungen wurden bei 68% der Patienten berichtet (siehe «Dosisanpassungen»).DosisanpassungenBei Patienten mit Knochenmarksdepression in der Vorgeschichte sollte die maximale Dosierung von 70 mg/m² Körperoberfläche Ribomustin i.v. an den Tagen 1 und 2 nicht überschritten werden; Wiederholung alle 4 Wochen.Die Behandlung soll nicht begonnen werden oder soll abgesetzt werden, wenn die Leukozyten und/oder die Thrombozyten auf Werte von ≤3’000/µl bzw. ≤75’000/µl abgefallen sind.Nach einem Anstieg der Leukozytenwerte auf ≥4’000/µl und der Thrombozyten auf ≥100’000/µl kann die Behandlung mit Ribomustin fortgesetzt werden.Der Leukozyten- und Thrombozyten-Nadir wird nach 14–20 Tagen erreicht und die Regeneration nach 3–5 Wochen.Darüber hinaus ist eine engmaschige Kontrolle des Blutbildes im therapiefreien Intervall zu empfehlen, wenn Ribomustin intermittierend in Therapiekursen und/oder in der Kombination mit anderen knochenmarkhemmenden Substanzen verabreicht wird, um – falls erforderlich – Dosisanpassungen vornehmen zu können.Spezielle DosierungsanweisungenLeberinsuffizienzAuf der Grundlage von pharmakokinetischen Daten ist keine Dosisanpassung bei Patienten mit 30–70% Tumor-/Metastasenbefall der Leber und leicht bis mässig verminderter Funktion der Leber (Serum-Bilirubin <3,0 mg/dl) nötig.Für Patienten mit schwerer Leberinsuffizienz (Serum-Bilirubin-Werte von >3,0 mg/dl) sind keine Daten verfügbar.NiereninsuffizienzBei Patienten mit einer Kreatinin-Clearance <50 ml/min sollte Ribomustin vorsichtig verabreicht werden.KinderEs gibt keine Erfahrungen mit Ribomustin bei Kindern. Die Anwendung von Ribomustin bei Kindern und Jugendlichen wird daher nicht empfohlen.Ältere PatientenEs gibt keine Hinweise, dass Dosisanpassungen bei älteren Patienten nötig sind (siehe auch «Pharmakokinetik»).KontraindikationenÜberempfindlichkeit gegenüber Bendamustin und/oder Mannitol.Schwangerschaft, Verdacht auf Schwangerschaft und während der Stillzeit.Schwere Leberparenchymschäden.Ikterus.Bestehende schwere Knochenmarkdepression und schwere Blutbildveränderungen.Vorangegangene grössere chirurgische Eingriffe weniger als 30 Tage vor Therapiebeginn.Infektionen, insbesondere einhergehend mit einer Leukozytopenie.Warnhinweise und VorsichtsmassnahmenHerzerkrankungen: Bei vorbestehenden Herzerkrankungen (z.B. Herzinfarkt, Ischämie, Herzrhythmusstörungen) sollte Ribomustin mit Vorsicht angewendet werden. Voraussetzung ist die Kontrolle der Erkrankung, die durch ein EKG abzusichern ist. Darüber hinaus sollte auf einen ausgeglichenen Wasser- und Elektrolythaushalt mit besonderer Berücksichtigung des Kaliumstoffwechsels geachtet werden. Bei K+ <3,5 mmol/l muss Kalium zugeführt und das EKG kontrolliert werden.Myelotoxizität: Das Blutbild sollte engmaschig überwacht werden und bei Leukozyten- und/oder Thrombozytenzahlen ≤3’000/µl bzw. ≤75’000/µl sollte die Behandlung unterbrochen werden bis die Werte wieder auf ≥4’000/µl bzw. ≥100’000/µl angestiegen sind. Gegebenenfalls ist die Behandlung im nächsten Zyklus mit reduzierter Dosis weiterzuführen.Infektionen: Infektionen einschliesslich Pneumonie und Sepsis wurden beschrieben. In seltenen Fällen waren die Infektionen mit Hospitalisierung, septischem Schock und Todesfällen verbunden. Patienten mit Neutropenie und/oder Lymphopenie nach einer Behandlung mit Bendamustinhydrochlorid sind anfälliger für Infektionen. Patienten mit Myelosuppression nach Behandlung mit Bendamustinhydrochlorid sollten darauf hingewiesen werden, bei Zeichen oder Symptomen einer Infektion, einschliesslich Fieber oder Atembeschwerden, umgehend einen Arzt zu kontaktieren.Tumorlyse-Syndrom: Bei Patienten, bei denen das Risiko eines Tumorlyse-Syndroms besteht (z.B. Patienten mit hoher Tumorlast >25×109/L), sollte die Behandlung sehr vorsichtig erfolgen. In einzelnen Studien wurde von Patienten mit Tumorlyse-Syndrom in Verbindung mit Ribomustin berichtet­. Ein Tumorlyse-Syndrom kann innerhalb von 48 Stunden nach der ersten Dosis von Bendamustinhydrochlorid einsetzen; ohne entsprechende Behandlung kann es zu akutem Nierenversagen führen und tödlich verlaufen. Vorsichtsmassnahmen umfassen adäquater Volumenstatus sowie engmaschige Überwachung des Blutbildes, insbesondere der Kalium- und Harnsäurespiegel.Kontrazeption: Bendamustinhydrochlorid ist teratogen und mutagen. Frauen sollten während der Behandlung nicht schwanger werden. Männer sollten während der Behandlung und bis zu 6 Monate danach kein Kind zeugen. Wegen der Möglichkeit einer irreversiblen Infertilität sollten sie vor der Behandlung über eine Spermienkonservierung beraten werden.Paravasate: Eine paravasale Fehlinjektion ist sofort zu stoppen, die Infusionsnadel sollte nach einer kurzen Aspiration entfernt werden. Danach sollte die Paravasatstelle gekühlt, der Arm hochgelagert werden. Weitere Behandlungsmassnahmen, z.B. die Verabreichung von Corticosteroiden, haben keinen eindeutigen Nutzen.Hautreaktionen: Es wurden verschiedene Hautreaktionen beschrieben. Zu diesen Ereignissen zählten Ausschlag (Rash), toxische Hautreaktionen und bullöse Exantheme. Einige traten auf, wenn Bendamustinhydrochlorid in Kombination mit anderen Zytostatika angewendet wurde; der genaue Zusammenhang ist daher nicht gesichert. Wenn Hautreaktionen auftreten, können diese progredient sein und sich bei fortgesetzter Behandlung verstärken. Bei progredienten Hautreaktionen ist die Behandlung mit Bendamustinhydrochlorid zu unterbrechen oder abzubrechen. Bei schweren Hautreaktionen mit Verdacht auf einen kausalen Zusammenhang mit Bendamustinhydrochlorid ist die Behandlung abzubrechen.Einzelne Fälle von Stevens-Johnson-Syndrom und toxisch epidermaler Nekrolyse wurden berichtet bei Patienten, die mit Bendamustinhydrochlorid in Kombination mit Allopurinol oder mit Allopurinol und Rituximab behandelt wurden.Sekundärtumore: Es gibt Berichte über Sekundärtumore einschliesslich myelodysplastisches Syndrom, akute myeloische Leukämie und Lungenkarzinom. Der kausale Zusammenhang mit der Behandlung mit Bendamustinhydrochlorid wurde nicht bestimmt.InteraktionenEs wuren keine in vivo-Interaktionsstudien durchgeführt.Bei der Kombination von Ribomustin mit anderen myelosuppressiven Substanzen kann die Wirkung von Ribomustin und/oder der zusätzlich verabreichten Arzneimittel auf das Knochenmark verstärkt werden. Grundsätzlich können alle Behandlungsmassnahmen, die den Allgemeinzustand des Patienten verschlechtern oder die Knochenmarkfunktion beeinträchtigen, die Toxizität von Ribomustin erhöhen.Zytostatika können die Antikörperbildung nach Influenzaimpfung mindern und das Risiko einer Infektion nach Lebendimpfung erhöhen.Das Cytochrom P450 (CYP) 1A2 Isoenzym ist am Stoffwechsel von Bendamustinhydrochlorid beteiligt. Deshalb ist eine potenzielle Interaktion mit CYP1A2-Hemmern wie z.B. Fluvoxamin, Ciprofloxacin oder Aciclovir gegeben.Schwangerschaft/StillzeitEs gibt keine hinreichenden Daten zur Anwendung bei Schwangeren. Tierexperimentelle Studien zeigten eine Reproduktionstoxizität. Das potenzielle Risiko für den Menschen ist nicht bekannt.Ribomustin ist während der Schwangerschaft und in der Stillzeit kontraindiziert.Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt.Unerwünschte WirkungenDie Art und Häufigkeit der Nebenwirkungen basieren auf den Daten von klinischen Phase-III-Studien und aus der spontanen Erfassung.Die Häufigkeiten sind eingeteilt in «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1’000, <1/100), «selten» (≥1/10’000, <1/1’000), «sehr selten» (<1/10’000).Infektionen und InfestationenSehr häufig: Infektionen.Selten: Sepsis.Sehr selten: Primäre atypische Pneumonie.Blut- und LymphsystemSehr häufig: Leukopenie (Lymphozytopenie und Granulozytopenie, WHO-Grad 1–4), Thrombozytopenie (WHO-Grad 1–4).Häufig: Hämorrhagie, Anämie.Sehr selten: Hämolyse. Verminderung CD4/CD8 Ratio. Verminderung der Lymphozytenzahl. Erhöhung des Infektionsrisikos (z.B. mit Herpes zoster).ImmunsystemSehr häufig: Abfall des Hämoglobins, Anstieg von Kreatinin, Anstieg von Harnstoff.Häufig: Überempfindlichkeit (wie allergische Dermatitis, Urtikaria).Selten: Anaphylaktische Reaktion, anaphylaktoide Reaktion.Sehr selten: Anaphylaktischer Schock.Stoffwechsel und ErnährungsstörungenHäufig: Anstieg von ASAT/ALAT (GOT/GPT), Anstieg der alkalischen Phosphatase und von Bilirubin, Hypokaliämie.NervensystemHäufig: Schlaflosigkeit.Selten: Somnolenz, Aphonie.Sehr selten: Geschmacksstörung, Parästhesie, periphere Neuropathie, anticholinergisches Syndrom, neurologische Störung, Ataxie, Enzephalitis.HerzHäufig: Dysfunktion des Herzens wie Palpitationen, Angina Pectoris, Arrhythmie.Gelegentlich: Perikarderguss.Sehr selten: Tachykardie, Myokardinfarkt, kardiopulmonales Versagen.GefässeHäufig: Hypotonie, Hypertonie.Selten: Akuter Kreislaufzusammenbruch.Sehr selten: Phlebitis.AtmungsorganeHäufig: Lungenfunktionsstörung.Sehr selten: Lungenfibrose.Gastrointestinale StörungenSehr häufig: Nausea, Erbrechen.Häufig: Durchfall, Verstopfung, Stomatitis.Sehr selten: Hämorrhagische Ösophagitis, gastrointestinale Blutung.HautSehr häufig: Alopezie (WHO Grad 1, 2).Häufig: Alopezie (WHO Grad 3), Hautveränderungen.Selten: Erythem, Dermatitis, Pruritus, makulopapuläres Exanthem/Rash, Hyperhidrosis.Sehr selten: Stevens-Johnson-Syndrom oder toxisch epidermale Nekrolyse.Reproduktionssystem und BrustdrüsenHäufig: Amenorrhö.Sehr selten: Unfruchtbarkeit.Allgemeine Störungen und Reaktionen an der ApplikationsstelleSehr häufig: Schleimhautentzündung, Fieber, Müdigkeit.Häufig: Schmerzen, Schüttelfrost, Dehydration, Anorexie, Tumorlyse-Syndrom.Sehr selten: Multiorganversagen. Nekrosen nach paravasaler Verabreichung.ÜberdosierungSymptomeNach einmaliger Bolus-Applikation wurde die maximal tolerierbare Dosis (MTD) von Bendamustinhydrochlorid mit 215 mg/m² ermittelt. Die dosislimitierenden Symptome waren Verwirrung, Lethargie, Schwindel, kardiale Dysfunktionen (einschliesslich Stenokardien, Tachyarrhythmien, Palpitationen, Angstgefühle, Schweissausbrüche), Mundtrockenheit und Geschmacksveränderungen.Nach einmaliger Verabreichung einer 30 min Infusion an Patienten mit soliden Tumoren lag die MTD bei 280 mg/m². In diesem Fall traten kardiale Ereignisse vom CTC-Grad 2 auf, die wegen ihrer klinischen Relevanz als dosislimitierend betrachtet wurden.Nach mehrfacher Bolus-Verabreichung an Tag 1–4 wurde eine MTD von 85 mg/m² ermittelt. Nach mehrfacher Kurzzeitinfusion von 30 min am Tag 1+2 resultierte eine MTD von 180 mg/m². In beiden Studien war die Myelosuppression mit verzögerter Regeneration dosislimitierend. Die Thrombozytopenie war stärker ausgeprägt als die Leukozytopenie.BehandlungEin spezifisches Antidot steht nicht zur Verfügung. Als wirksame Gegenmassnahmen zur Beherrschung hämatologischer Nebenwirkungen können Knochenmarktrans­plantationen und Transfusionen (Thrombozyten, Erythrozytenkonzentrate) durchgeführt oder hämatologische Wachstumsfaktoren gegeben werden.Bendamustinhydrochlorid und seine Metabolite sind in geringem Masse dialysierbar.Eigenschaften/WirkungenATC-Code: L01AA09Bendamustinhydrochlorid ist eine alkylierende anti-neoplastische Substanz mit besonderem Wirkmechanismus. Die anti-neoplastische und zelltoxische Wirkung von Bendamustinhydrochlorid basiert im Wesentlichen auf einer Quervernetzung der DNA-Einzel- und Doppelstränge durch Alkylierung. Hierdurch werden die Matrixfunktionen und die Synthese und Reparatur der DNA gestört. Darüber hinaus gibt es Hinweise, dass Bendamustinhydrochlorid zusätzliche Antimetaboliten-Eigenschaften besitzt (purin­analoge Wirkung).Die anti-neoplastische Wirkung von Bendamustinhydrochlorid wurde durch viele in vitro-Studien an verschiedenen Tumor-Zell-Linien gezeigt (Mammakarzinom, nicht-kleinzelliges und kleinzelliges Bronchialkarzinom, Ovarialkarzinom und verschiedene Leukämien) und in vivo an verschiedenen experimentellen Tumormodellen mit Tumoren von Maus, Ratte und menschlichen Ursprungs (Melanome, Mammakarzinom, Sarkome, Lymphome, Leukämien und kleinzelliges Bronchialkarzinom).Bendamustinhydrochlorid zeigt in menschlichen Tumor-Zell-Linien ein unterschiedliches Aktivitätsprofil als dasjenige von anderen alkylierenden Substanzen. Die Substanz zeigt keine oder nur sehr geringe Kreuzresistenz in menschlichen Tumor-Zell-Linien mit verschiedenen Substanz-Resistenz-Mechanismen, zumindest teilweise durch eine länger anhaltende Interaktion mit der DNA.Darüber hinaus konnte in klinischen Studien gezeigt werden, dass keine komplette Kreuzresistenz zwischen Bendamustin und Anthrazyklinen, alkylierenden Substanzen oder Rituximab besteht.Klinische Studie bei chronischer lymphatischer LeukämieIn einer prospektiven, multizentrischen, randomisierten, offenen Studie wurden 305 therapiebedürftige Patienten mit chronischer lymphatischer Leukämie im Stadium Binet B oder C eingeschlossen. Die Primärtherapie mit Bendamustin 100 mg/m² i.v. an den Tagen 1 und 2 (Therapie B) wurde mit einer Behandlung mit Chlorambucil 0,8 mg/kg an den Tagen 1 und 15 (Therapie C) verglichen. Patienten unter dem Therapieschema B haben ein signifikant längeres medianes progressionsfreies Überleben als Patienten unter dem Therapieschema C (22 versus 9 Monate, p <0,0001). Die mediane Dauer der Remission beträgt 19 Monate unter dem Therapieschema B und 6 Monate unter dem Therapieschema C (p <0,0001). Die Analyse der Sicherheitsdaten beider Behandlungsarme zeigte keine unerwarteten unerwünschten Wirkungen, weder in Art noch in Häufigkeit.Klinische Studien beim Non-Hodgkin-Lymphom in Kombination mit RituximabDie pivotale randomisierte Phase III Studie verglich die Erstlinientherapie mit 4-wöchentlichen Zyklen Ribomustin 90 mg/m² i.v. an den Tagen 1 und 2 in Kombination mit 375 mg/m² Rituximab i.v. an Tag 1 (BR-Therapie) mit 3-wöchentlichen Zyklen Rituximab 375 mg/m² i.v. an Tag 1 und Standard-CHOP (750 mg/m² Cyclophosphamid, 50 mg/m² Doxorubicin, 1,4 mg/m² Vincristin und 100 mg Prednison) bei insgesamt 549 Patienten mit einem fortgeschrittenen indolenten Non-Hodgkin-Lymphom (NHL) oder Mantelzell-Lymphom. Es wurden bei 82% der BR-Patienten und bei 86% der R-CHOP-Patienten die maximal 6 Zyklen verabreicht. Es wurde eine statistisch signifikante und klinisch bedeutsame Verbesserung des progressionfreien Überlebens bei Beurteilung durch den Investigator bei den BR-Patienten verglichen mit den R-CHOP-Patienten erreicht (Median 61,4 Monate vs 31,3 Monate, HR= 0,607, p <0,0001). Mit Ausnahme der vergleichbaren Marginalzonen-Lymphom-Resultate blieb dieser signifikante Unterschied des progressionfreien Überlebens der beiden Therapien auch in den histologischen Subentitäten und Altersgruppen (<65 Jahre und ≥65 Jahre) erhalten. Die BR-Behandlung resultierte auch in signifikant höheren kompletten Remissionsraten (43% vs 29%, p <0,0009). Bei Beurteilung durch das unabhängige Review Komitee war das progressionsfreie Überleben nach WHO Kriterien 30,6 vs 23,3 Monate, HR= 0,735 (0,50, 1,08), p= 0,0420 und nach IWG Kriterien 33,1 vs 28,2 Monate, HR= 0,687 (0,45, 1,05), p= 0,03.Die Zwischenauswertung des unabhängigen Review Komitees einer weiteren randomisierten, offenen Parallel-Gruppen Studie mit Bendamustinhydrochlorid und Rituximab (BR) verglichen mit Rituximab, Cyclophosphamid, Vincristin und Prednison (R-CVP) oder Rituximab, Cyclophosphamid, Doxorubicin, Vincristin und Prednison (R-CHOP) in der Erstlinienbehandlung von 336 Patienten mit fortgeschrittenem indolenten NHL oder Mantelzell-Lymphom zeigte ebenfalls ein besseres Ansprechen zugunsten von BR (komplette Remissionen: 31% vs 25%; Gesamtansprechen 96% vs 91%). Das Ansprechen in der indolenten NHL Population war gleich gut. Myelosuppression (72% vs 43%), Alopezie (35% vs 3%) sowie periphere Neuropathien (25% vs 3%) waren häufiger unter R-CHOP/R-CVP-Behandlung, währenddem es im BR-Behandlungsarm zu mehr Haut- und Hypersensibilitäts-Reaktionen kam (16% vs 8% und 10% vs 4%).Klinische Studien beim indolenten Non-Hodgkin-Lymphom nach Behandlung mit RituximabIn einer nicht kontrollierten, multizentrischen, offenen Studie wurden 100 Patienten mit indolentem B-Zell-Non-Hodgkin-Lymphom, die auf eine Mono- oder Kombinationstherapie mit Rituximab nicht angesprochen hatten, mit Bendamustinhydrochlorid als Monotherapie behandelt. Die Patienten hatten median 3 vorhergehende Therapiezyklen mit Chemotherapie erhalten und hatten median 2 vorhergehende Zyklen mit einer Rituximab-enthaltenden Therapie erhalten. Die Patienten hatten nicht auf die Vortherapie mit Rituximab angesprochen oder waren progredient innerhalb von 6 Monaten. Die Dosis von Bendamustinhydrochlorid betrug 120 mg/m² i.v. an den Tagen 1 und 2 und war für mindestens 6 Therapiezyklen geplant. Bei Beurteilung durch ein unabhängiges Review Komitee betrug die Gesamtansprechrate 75%, CR und CRu 17%, PR 58%. Die mediane Remissionsdauer betrug 40 Wochen.In einer weiteren nicht kontrollierten, multizentrischen, offenen Studie mit 76 Patienten wurden Patienten mit indolentem oder transformiertem B-Zell-Non-Hodgkin-Lymphom untersucht. Die Patienten hatten innerhalb von 6 Monaten nicht auf die Behandlung mit Rituximab Mono- oder Kombinationstherapie angesprochen oder es traten bei früheren Behandlungen mit Rituximab Nebenwirkungen auf. Die Patienten hatten median 3 vorhergehende Zyklen einer Chemotherapie oder einer biologischen Therapie erhalten sowie median 2 Zyklen Rituximab. Die Gesamtansprechrate betrug 76% bei einer medianen Ansprechdauer von 5 Monaten (29 Wochen [95% CI 22,1, 43,1]).In einer dritten nicht kontrollierten, multizentrischen, offenen Studie mit 69 Patienten wurden Patienten mit rezidiviertem oder refraktärem indolenten Non-Hodgkin-Lymphom oder Mantelzelllymphom eingeschlossen, welche mit 1–7 Chemotherapien und/oder biologischen Therapien vorbehandelt waren, wobei 25 Patienten auf Rituximab nicht angesprochen hatten. Die Gesamtansprechrate aller Patienten betrug 91,3%, respektive 96,0% bei den Rituximab-refraktären Fällen; das mittlere progressionsfreie Überleben wurde nach 12 Monaten Beobachtungszeit noch nicht erreicht.PharmakokinetikDistributionUnter Steady-State-Bedingungen beträgt das Verteilungsvolumen 15,8–20,5 l.Die Substanz wird zu >95% an Plasmaproteine gebunden (vorzugsweise Albumin).MetabolismusBendamustinhydrochlorid wird hauptsächlich in der Leber metabolisiert. Ein Hauptweg der Ausscheidung von Bendamustinhydrochlorid ist die Hydrolyse zu Monohydroxy- und Dihydroxy-bendamustin. Die Bildung von N-Desmethyl-Bendamustin und eines oxidierten Metaboliten geht über das Cytochrom P450 (CYP) 1A2 Isoenzym. Ein weiterer Hauptausscheidungsweg von Bendamustin erfolgt über Konjugation mit Glutathion.In in vitro-Untersuchungen hemmt Bendamustin CYP 1A4, CYP 2C9/10, CYP 2D6, CYP 2E1 und CYP 3A4 nicht.EliminationDie terminale Eliminationshalbwertszeit t½β beträgt 28,2 Minuten.Die mittlere totale Clearance wurde mit 639,4 ml/min errechnet.Ungefähr 20% der verabreichten Dosis wurden im Urin innerhalb von 24 Stunden wieder gefunden, die Hälfte davon als aktive Muttersubstanz.Über die Galle werden hauptsächlich polare Metaboliten ausgeschieden (0,1% aktive Muttersubstanz).Die Kombinationstherapie von Bendamustinhydrochlorid 90 mg/m² oder 120 mg/m² i.v. an den Tagen 1 und 2 mit 375 mg/m² Rituximab i.v. an Tag 1 weist nicht auf eine Beeinflussung von Rituximab auf die Pharmakokinetik von Bendamustin hin und unverändertes Bendamustin wurde rasch eliminiert.Kinetik spezieller PatientengruppenLeberinsuffizienzBei Patienten mit 30–70% Tumorbefall/Metastasierung der Leber und normaler oder leicht bis mässig verminderter Funktion der Leber (Serum Bilirubin <3,0 mg/dl) ist die Pharmakokinetik von Bendamustin nicht verändert. Patienten mit Leberinsuffizienz nach Child-Pugh B/C wurden nicht untersucht.NiereninsuffizienzDaten bei Patienten mit eingeschränkter Nierenfunktion sind limitiert.Ältere PatientenPersonen bis zum Alter von 84 Jahren waren in pharmakokinetischen Studien eingeschlossen. Hohes Alter beeinflusst die Pharmakokinetik von Bendamustin nicht.Präklinische DatenUnerwünschte Wirkungen, die nicht in klinischen sondern in tierexperimentellen Studien, bei einer Exposition ähnlich der humantherapeutischen Exposition auftraten, und als möglicherweise relevant für die klinische Anwendung zu bewerten sind, waren folgende:In histologischen Untersuchungen bei Hunden wurden makroskopisch sichtbare Mukosahyperämien und Hämorrhagien im Darm gefunden. Mikroskopisch liessen sich starke Veränderungen des lymphatischen Gewebes als Indikator einer Immunsuppression und tubuläre Veränderungen von Niere und Testis, sowie atrophisch nekrotische Veränderungen des Prostataepithels nachweisen.Tierstudien zeigen, dass Bendamustin embryotoxisch und teratogen ist.Bendamustin induziert Chromosomenaberrationen und wirkt in vivo und in vitro mutagen. In Langzeituntersuchungen an weiblichen Mäusen wirkt Bendamustin kanzerogen.In einem in vitro-Versuch an HEK-Zellen wurde der Kaliumstrom durch stabil exprimierte hERG-Kanäle mit 200 µM Bendamustin zu 65% gehemmt. Es gibt jedoch keine weiteren Hinweise aus präklinischen Studien für ein kardiovaskuläres Risiko (QT-Verlängerungen).Sonstige HinweiseInkompatibilitätenRibomustin darf nicht mit anderen Substanzen (insbesondere nicht mit Glukose) in einer Infusion vermischt werden. Das Lyophilisat darf nur mit Wasser für Injektionszwecke gelöst und mit isotonischer Kochsalzlösung weiter verdünnt werden.HaltbarkeitDas Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.Besondere LagerungshinweiseVor Licht geschützt, unter 25 °C und für Kinder unerreichbar lagern.Rekonstituiertes Konzentrat in der DurchstechflascheDas Konzentrat soll nach der Rekonstitution sofort weiterverarbeitet werden.Verdünnte Lösung zur InfusionDie chemische und physikalische Stabilität der Zubereitung nach Zumischen zu der genannten Infusionslösung (Wasser für Injektionszwecke und isotonische Kochsalzlösung) wurde für 3,5 Stunden bei 25 °C/60% relative Luftfeuchtigkeit und 2 Tage bei Lagerung im Kühlschrank (2–8 °C) in Polyethylenbeuteln nachgewiesen. Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort verwendet werden.Hinweise für die HandhabungHinweis betreffend Zytostatika: Bei der Zubereitung und Handhabung von Ribomustin sind die Vorschriften für Zytostatika einzuhalten.Zur Herstellung der gebrauchsfertigen Lösung wird der Inhalt einer Durchstechflasche Ribomustin in Wasser für Injektionszwecke gelöst und mit isotonischer Kochsalzlösung verdünnt. Es ist unter aseptischen Bedingungen zu arbeiten.1. RekonstitutionDurchstechflasche Ribomustin mit 25 mg Bendamustinhydrochlorid in 10 ml Wasser für Injektionszwecke unter Schütteln lösen.Durchstechflasche Ribomustin mit 100 mg Bendamustinhydrochlorid in 40 ml Wasser für Injektionszwecke unter Schütteln lösen.Die so erhaltene Lösung enthält 2,5 mg/ml Bendamustinhydrochlorid und ist eine klare, farblose Lösung.2. VerdünnungSobald eine klare Lösung (in der Regel nach 5–10 Minuten) vorliegt, wird die Ribomustin Gesamtdosis sofort mit 0,9%iger NaCl-Lösung bis zu einem Endvolumen von ca. 500 ml verdünnt.Ribomustin darf, ausser mit isotonischer Kochsalzlösung, nicht mit anderen Basisinfusionslösungen oder anderen Injektionslösungen verdünnt werden.3. VerabreichungRibomustin wird als i.v. Kurzzeitinfusion über 30–60 min verabreicht.Zulassungsnummer58816 (Swissmedic).ZulassungsinhaberinMundipharma Medical Company, Hamilton/Bermuda, Zweigniederlassung Basel.Stand der InformationJuni 2012.Verwendung dieser InformationenDie Informationen auf dieser Seite sind für Fachpersonal gedacht. Bei Fragen lassen Sie sich von einer Fachperson (z.B. Arzt oder Apotheker) beraten.用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 苯达莫司汀,苯达莫司汀冻干粉注射剂(Ribomustin Trockensubstanz 100mg)
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 苯达莫司汀,苯达莫司汀冻干粉注射剂(Ribomustin Trockensubstanz 100mg)


