美罗华冻干粉注射剂Rituximab(Mabthera 1400mg)
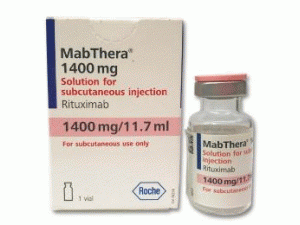 产地国家:德国
处方药:是
所属类别: 1400毫克 1瓶
包装规格: 1400毫克 1瓶
计价单位: 瓶
生产厂家英文名:Roche Pharma AG
原产地英文商品名:MABTHERA 1400mg Lösung zur subkutanen Injektion, 1ST
原产地英文药品名:Rituximab
中文参考商品译名:MabThera射剂型 1400毫克 1瓶
中文参考药品译名:利妥昔单抗
产地国家:德国
处方药:是
所属类别: 1400毫克 1瓶
包装规格: 1400毫克 1瓶
计价单位: 瓶
生产厂家英文名:Roche Pharma AG
原产地英文商品名:MABTHERA 1400mg Lösung zur subkutanen Injektion, 1ST
原产地英文药品名:Rituximab
中文参考商品译名:MabThera射剂型 1400毫克 1瓶
中文参考药品译名:利妥昔单抗
简介
部份中文美罗华处方资料(仅供参考) 药品英文名:Rituximab 药品别名:美罗华、科妥昔单抗、MabThera、Rituxan 药物剂型:注射剂,500mg(50ml),100mg(10ml)。 药理作用:本品与纵贯细胞膜的CD20抗原特异性结合。该抗原位于前B细胞和成熟B淋巴细胞,但在造血干细胞、后B细胞、正常血浆细胞,或其他正常组织中不存在。该抗原表达于95%以上的B淋巴细胞型的非霍奇金淋巴瘤。在与抗体结合后,CD20不被内在化或从细胞膜上脱落。CD20不以游离抗原形式在血流中循环,因此,也就不会与抗原竞争性结合。本品与B淋巴细胞上的CD20结合,并引发B细胞溶解的免疫反应。细胞溶解的可能机制包括补体依赖性细胞毒性(CDC)和抗体依赖性细胞的细胞毒性(ADCC)。此外,体外研究表明,本品可使药物抵抗性的人体淋巴细胞对一些化疗药物的细胞毒敏感。 药动学:给予125mg/m2,250mg/m2或375mg/m2的本品,静脉输注,每周1次,共4次。接受本品者的血清抗体浓度随剂量的增加而上升。在给予375mg/m2的患者中,在第一次输注后,本品的血浆t1/2为68.1h,血药峰值为238.7μg/ml,平均血浆清除率为每小时0.0459L。在第4次输注后,平均血清半衰期最高浓度和血浆清除率分别为每小时189.9,480.7和0.0145L。此外,本品的血药浓度在缓解患者中的增高具有统计学意义,其典型意义是在3~6个月后仍可测到本品。在第1次给药后,中位外周B淋巴细胞数明显降低至正常水平以下,6个月后开始恢复,在治疗完成的9~12个月后恢复正常。 适应证:主要适用于中低度非霍奇金淋巴瘤,使用前需要对淋巴瘤病理切片进行CD20表达的检测,以求治疗的准确性和保证疗效。适用于复发或化疗抵抗性B淋巴细胞型的非霍奇金淋巴瘤患者。 禁忌证:1.对本品或鼠蛋白过敏者、孕妇、哺乳者禁用。2.儿童禁用。 注意事项 1.有明显心脏病如心绞痛、心衰、哮喘、低血压等患者慎用。 2.输注速度不可过快,也不可进行静脉注射。 3.用药期间如发生变态反应或其他严重反应,应考虑减量或停药。 4.考虑本品可能引起低血压,因此,在开始使用本品时,应暂停使用抗高血压药或减量。 5.应准备好抢救过敏性休克的措施。 6.血细胞和血小板计数明显下降时,应停药。 7.用药期间,应定期检查血常规和血小板计数。 8.本品不可静脉推注。 9.避光,在2~8℃冰箱中保存。 不良反应:由于接受治疗的患者大多数都曾接受过多种抗癌治疗,其预后均较差,以下列出的不良反应不一定都是使用本品引起的,临床应进行细致分析。 1.与输注直接相关的不良反应有发热、寒战,主要发生在第1次输注中,通常在给药后2h内发生。继而发生荨麻疹、皮疹、疲劳、头痛、瘙痒、支气管痉挛、呼吸困难、舌或喉头水肿(血管神经性水肿)、鼻炎、呕吐、一过性低血压、潮红、心律失常和肿瘤部位疼痛。 2.原有心脏病的发作,如心绞痛和充血性心衰加重。不良反应有可能随继续用药而减轻。 3.少数患者有出血倾向,常较轻且可逆。严重的血小板减少和中性粒细胞减少的发生率为1.8%。严重贫血的发生率为1.4%。 4.全身不良反应还有腹胀、腹痛、背痛、胸痛、颈痛、盗汗、汗多、皮肤干燥和输注部位疼痛。 5.心血管系统的不良反应有高血压、直立性低血压、心动过缓、心动过速、血管扩张。 6.胃肠道可见腹泻、厌食和消化不良。 7.白细胞减少、淋巴结病、高血糖、周围水肿、LDH增高、体重减轻、低血钙和血尿酸升高。 8.关节痛、肌痛、骨痛、张力过高。 9.神经系统的不良反应可见眩晕、焦虑、抑郁、感觉异常、躁动、失眠、精神紧张、嗜睡和神经炎。 10.泪腺分泌紊乱、耳痛、味觉障碍、排尿困难和血尿可能发生。 用法用量:1.作为成年患者的单一治疗药,推荐剂量为375mg/m2,静脉输注前1h先给予止痛药(对乙酰氨基酚)和抗过敏药(苯海拉明)。首剂输注速度为每小时50mg,以后每30分钟增加每小时50mg,最高可达每小时400mg。每周1次,连用4次。2.如患者耐受,可将输入速度提高为每小时100mg,以后每30分钟增加每小时100mg,最高可达每小时400mg。 药物相应作用:不可与其他药物混用。 贮藏/有效期:瓶装制剂应保存于2-8°C,未稀释的药瓶应避光。配置好的本药液体,室温可存放12小时。如配置好的液体不能立即使用,在未受室温影响其稳定性时,将其存放于冰箱中(2-8°C),可保存24小时。英文版说明书
Mabthera Infusionskonzentrat 100mg/10ml 2 Ampullen 10mlFachinformationenZusammensetzungWirkstoff: Rituximabum.Hilfsstoffe: Natrii citras, polysorbatum 80 (aus gentechnisch verändertem Mais hergestellt), natrii chloridum, aqua ad iniectabilia.Galenische Form und Wirkstoffmenge pro Einheit1 Durchstechflasche mit 10 ml Konzentrat zur Herstellung einer Infusionslösung enthält 100 mg Rituximab.1 Durchstechflasche mit 50 ml Konzentrat zur Herstellung einer Infusionslösung enthält 500 mg Rituximab.Indikationen/AnwendungsmöglichkeitenNon-Hodgkin-LymphomMonotherapie bei Patienten mit CD20 positivem follikulärem Non-Hodgkin-Lymphom (Stadien III-IV), bei Rezidiv nach oder Nichtansprechen auf Chemotherapie.Behandlung von vorgängig unbehandelten Patienten mit CD20 positivem follikulärem Non-Hodgkin-Lymphom (Stadien III-IV) mit hohem Tumorload in Kombination mit CVP oder CHOP. Bei Ansprechen auf die Therapie kann eine Erhaltungstherapie mit Rituximab Monotherapie über 2 Jahre verabreicht werden.Erhaltungstherapie von Patienten mit CD20 positivem rezidiviertem oder refraktärem follikulärem Non-Hodgkin-Lymphom (Stadien III-IV), die auf eine Induktionstherapie mit CHOP mit oder ohne Rituximab angesprochen haben.Behandlung von Patienten mit einem CD20 positiven diffusen grosszelligen B-Zell-Non-Hodgkin-Lymphom (DLBCL) in Kombination mit Standard-CHOP (8 Zyklen Cyclophosphamid, Doxorubicin, Vincristin, Prednison).Behandlung von Patienten mit therapiebedürftiger chronischer lymphatischer Leukämie (CLL) in Kombination mit Fludarabin und Cyclophosphamid (R-FC). Patienten mit Vortherapie von Fludarabin sollten über eine Dauer von mindestens 6 Monaten angesprochen haben.Rheumatoide ArthritisMabThera in Kombination mit Methotrexat (MTX) ist zur Behandlung erwachsener Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis (RA) indiziert nach Versagen einer oder mehrerer Therapien mit Tumornekrosefaktor- (TNF-) Hemmern.ANCA-assoziierte Vaskulitis (AAV)MabThera in Kombination mit Kortikosteroiden ist zur Behandlung von Patienten mit schwerer aktiver ANCA-assoziierter Vaskulitis (Granulomatose mit Polyangiitis (auch bekannt als Morbus Wegener) und mikroskopische Polyangiitis) indiziert.Dosierung/AnwendungDie Infusionen von MabThera sollten in einer medizinischen Einrichtung durchgeführt werden, in der die Mittel für eine wirksame Reanimation sofort eingesetzt werden können. Die Infusionen sollten unter unmittelbarer Aufsicht eines im jeweiligen Anwendungsbereich erfahrenen Arztes verabreicht werden. MabThera kann ambulant verabreicht werden. Patienten, die respiratorische Symptome oder Hypotension entwickeln, sollten während mindestens 24 Stunden überwacht werden.MabThera wird nach Verdünnung mittels eines separaten Zugangs als intravenöse Infusion verabreicht. MabThera darf nicht unverdünnt i.v. injiziert werden und die zubereitete Infusionslösung darf nicht als Kurzinfusion verabreicht werden.Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.Vor jeder Verabreichung von MabThera soll stets eine Prämedikation, bestehend aus einem Analgetikum/Antipyretikum (z.B. Paracetamol/Acetaminophen) und einem Antihistaminikum (z.B. Diphenhydramin), verabreicht werden.Eine Prämedikation mit Glukokortikoiden sollte ebenfalls in Erwägung gezogen werden, insbesondere, wenn MabThera nicht in Kombination mit einer steroidhaltigen Chemotherapie verabreicht wird (siehe «Warnhinweise und Vorsichtsmassnahmen»).Dosisanpassungen während der Behandlung:Es wird nicht empfohlen, die Dosis von MabThera zu reduzieren. Wenn MabThera in Kombination mit einer Chemotherapie verabreicht wird, sollten die üblichen Dosisreduktionen der Chemotherapeutika durchgeführt werden.Erste Infusion: Die empfohlene initiale Infusionsgeschwindigkeit beträgt 50 mg/h; sie kann nach den ersten 60 Minuten stufenweise alle 30 Minuten um 50 mg/h auf einen Höchstwert von 400 mg/h gesteigert werden.Weitere Infusionen: Weitere Infusionen von MabThera können mit einer Infusionsgeschwindigkeit von 100 mg/h begonnen werden, die im weiteren Verlauf in Abständen von 30 Minuten um 100 mg/h bis auf einen Höchstwert von 400 mg/h gesteigert werden kann.Die Patienten sind engmaschig auf Anzeichen eines beginnenden Zytokinfreisetzungssyndroms (Cytokine Release Syndrome) zu überwachen (siehe «Warnhinweise und Vorsichtsmassnahmen»). Bei Patienten, die Anzeichen von schweren unerwünschten Arzneimittelwirkungen (UAW) zeigen, insbesondere schwere Dyspnoe, Bronchospasmus oder Hypoxie, ist die Infusion sofort zu unterbrechen. Zudem sind Patienten mit follikulärem Non-Hodgkin-Lymphom, DLBCL oder CLL auf Anzeichen eines Tumorlysesyndroms zu untersuchen. Bei Patienten mit vorbestehender respiratorischer Insuffizienz oder pulmonaler Tumorinfiltration muss eine Röntgenaufnahme des Thorax erfolgen. Bei allen Patienten darf die Infusion erst dann wieder begonnen werden, wenn alle klinischen Symptome vollständig verschwunden und die Laborwerte im Normbereich sind. Zu diesem Zeitpunkt kann die Infusion mit auf die Hälfte reduzierter Infusionsgeschwindigkeit wieder aufgenommen werden. Wenn dieselben schweren unerwünschten Arzneimittelwirkungen erneut auftreten, ist ein Abbruch der Behandlung zu erwägen.Non-Hodgkin Lymphom (NHL)Follikuläres Non-Hodgkin-LymphomMonotherapie: Die empfohlene Dosierung beträgt 375 mg/m2 Körperoberfläche einmal wöchentlich als intravenöse Infusion während 4 Wochen.Kombinationstherapie: Die empfohlene Dosierung von MabThera in Kombination mit einer CVP oder CHOP Chemotherapie beträgt 375 mg/m2 Körperoberfläche einmal pro Zyklus über 8 Behandlungszyklen. Die Dosis von MabThera wird jeweils am ersten Tag jedes Chemotherapiezyklus nach der oralen Verabreichung der Glukokortikoid-Komponente der Chemotherapie gegeben.ErhaltungstherapieBei unbehandelten Patienten wird MabThera einmal alle 2 Monate (375 mg pro m² Körperoberfläche) bis zum Fortschreiten der Krankheit bzw. bis zu einer Höchstdauer von zwei Jahren verabreicht (insgesamt 12 Infusionen).Bei rezidivierten oder refraktären Patienten, die auf eine Induktionstherapie angesprochen haben, wird MabThera einmal alle 3 Monate (375 mg pro m² Körperoberfläche) bis zum Fortschreiten der Krankheit, bzw. bis zu einer Höchstdauer von zwei Jahren verabreicht (insgesamt 8 Infusionen).Diffuses grosszelliges B-Zell-Non-Hodgkin-LymphomBei Patienten mit diffusem grosszelligem B-Zell-Non-Hodgkin-Lymphom sollte MabThera zusätzlich zu einer CHOP-Chemotherapie angewendet werden. Die empfohlene Dosierung von MabThera beträgt 375 mg/m2 Körperoberfläche einmal alle 3 Wochen über 8 Behandlungszyklen. Die Dosis von MabThera wird jeweils am ersten Tag jedes Chemotherapiezyklus nach der i.v. Verabreichung der Glukokortikoid-Komponente der CHOP-Chemotherapie gegeben.Chronische lymphatische Leukämie (CLL)Es wird empfohlen, 48 Stunden vor Therapiebeginn eine Prophylaxe mit ausreichender Flüssigkeitszufuhr und die Verabreichung von Urostatika einzuleiten, um das Risiko eines Tumorlysesyndroms zu verringern.Weiterhin sollte eine Prämedikation mit Glukokortikoiden kurz vor Beginn der Infusion mit MabThera erwogen werden, um die Häufigkeit und den Schweregrad akuter Infusionsreaktionen (IRRs) und/oder eines Zytokinfreisetzungssyndroms zu verringern.Die empfohlene Dosis von MabThera bei vorgängig unbehandelten und bei rezidivierten/refraktären CLL-Patienten beträgt 375 mg/m2 Körperfläche am Tag 1 des ersten Behandlungszyklus, gefolgt von 500 mg/m2 Körperfläche am Tag 1 von Zyklus 2-6 (in vierwöchigen Abständen). Fludarabin 25 mg/m2 und Cyclophosphamid 250 mg/m2 werden im ersten Zyklus am Tag 2, 3 und 4 und in den Zyklen 2-6 an Tag 1-3 verabreicht.Folgende Dosisanpassungen werden empfohlen, wenn schwere Infektionen auftraten oder wenn am Tag 28 eines Zyklus Grad 3 oder 4 Zytopenien (Anämie, Neutropenie, Thrombozytopenie) auftraten, welche nicht auf eine Knochenmark-Beteilung schliessen lassen:Die Behandlung kann um 2 Wochen mit einer gleichzeitigen Dosisreduktion von Fludarabin und Cyclophosphamid um 25% in den folgenden Zyklen aufgeschoben werden.Falls nach dieser ersten Dosisreduktion eine zweite Grad 3 und 4 Zytopenie unabhängig einer Knochenmark-Beteiligung am Tag 28 eines Zyklus auftritt, kann die Behandlung mit einer weiteren Dosisreduktion von Fludarabin und Cyclophosphamid um 25% nochmals bis zu 2 Wochen verzögert werden. Dies entspricht 50% der normalen Fludarabin/Cyclophosphamid Dosis.Rheumatoide ArthritisZur Verringerung der Häufigkeit und des Schweregrades von IRRs soll eine Prämedikation mit Glukokortikoiden verabreicht werden. Die Patienten sollten 100 mg Methylprednisolon i.v. erhalten; die Gabe sollte jeweils 30 Minuten vor jeder Infusion mit MabThera abgeschlossen sein (siehe «Warnhinweise und Vorsichtsmassnahmen»).Ein Behandlungszyklus mit MabThera besteht aus zwei i.v. Infusionen zu je 1'000 mg im Abstand von 2 Wochen. Je nach Krankheitsverlauf können weitere Behandlungszyklen verabreicht werden.Erste Infusion:Die empfohlene initiale Infusionsgeschwindigkeit beträgt 50 mg/h; sie kann nach den ersten 30 Minuten stufenweise alle 30 Minuten um 50 mg/h auf einen Höchstwert von 400 mg/h gesteigert werden. Dies entspricht einer Verabreichungsdauer von 4 Stunden und 15 Minuten.Weitere Infusionen von MabThera können mit einer Infusionsgeschwindigkeit von 100 mg/h begonnen werden, die im weiteren Verlauf in Abständen von 30 Minuten jeweils um 100 mg/h bis auf einen Höchstwert von 400 mg/h gesteigert werden kann. Dies entspricht einer Verabreichungsdauer von 3 Stunden und 15 Minuten.Alternative Verabreichung von darauf folgenden Infusionen mit einer Konzentration von 4 mg/ml in einem Volumen von 250 ml über 120 Minuten:Wenn die Patienten bei ihrer vorgängigen Infusion kein schwerwiegendes infusionsbedingtes unerwünschtes Ereignis entwickelt haben, kann die nächste Infusion mit einer Dauer von 2 Stunden verabreicht werden. Für diese Verabreichungsvariante wird empfohlen, eine Infusionslösung mit einer Konzentration von 4 mg/ml in einem Volumen von 250 ml herzustellen (entspricht 1 g MabThera auf 250 ml fertige Infusionslösung). Begonnen wird dabei mit einer Infusionsgeschwindigkeit von 250 mg/h in den ersten 30 Minuten und fortgesetzt mit einer Geschwindigkeit von 600 mg/h über die nächsten 90 Minuten. Wird die Infusion über 2 Stunden vertragen, kann diese Infusionsgeschwindigkeit bei den weiteren Infusionen und Zyklen beibehalten werden.Patienten mit klinisch signifikanter kardiovaskulärer Krankheit, einschliesslich Herzrhythmusstörungen, oder mit schwerwiegenden IRRs auf eine vorgängige biologische Therapie oder auf MabThera, sollten nicht mit der Infusionsalternative über 2 Stunden behandelt werden.Nach Beendigung der Infusion sollte der intravenöse Zugang während mindestens 1 Stunde in situ belassen werden, damit bei Bedarf Arzneimittel i.v. verabreicht werden können. Treten während dieser Zeit keine unerwünschten Arzneimittelwirkungen auf, kann der intravenöse Zugang entfernt werden.In einer Dosisfindungsstudie bei einer weniger therapieresistenten Patientenpopulation, die nicht auf eine Vorbehandlung mit DMARDs (disease modifying antirheumatic drugs) angesprochen hatte, erwies sich die Behandlung mit 2× 500 mg pro Zyklus als ähnlich wirksam wie 2× 1'000 mg (gemäss dem Endpunkt ACR20). Dosen von weniger als 2× 500 mg pro Zyklus wurden nicht untersucht.Der Bedarf für weitere Zyklen sollte 24 Wochen nach dem vorherigen Zyklus aufgrund von verbleibender oder wiedergekehrter Krankheitsaktivität beurteilt werden. Eine Wiederbehandlung sollte erfolgen, wenn die verbleibende Krankheitsaktivität über einem DAS28-ESR-Wert von 2.6 liegt. Wenn der DAS28-ESR-Wert unter 2.6 liegt, sollte eine Wiederbehandlung erfolgen, sobald die Krankheitsaktivität wieder ansteigt (auf DAS28-ESR >2.6).Die Behandlung mit MabThera sollte lediglich bei Patienten fortgeführt werden, bei denen der DAS28-ESR-Wert nach zwei Behandlungszyklen um mindestens 1.2 DAS28-ESR Einheiten abgefallen ist.Liegt der letzte Behandlungszyklus mit MabThera ≥52 Wochen zurück, sollte bei der ersten Infusion des neuen Zyklus die gleiche Infusionsgeschwindigkeit wie bei der Erstdosis gewählt werden.Bei Vorbehandlung mit TNF-Hemmern muss vor Beginn der Therapie mit MabThera die Therapie mit Etanercept für mindestens 4 Wochen und mit Infliximab oder Adalimumab für mindestens 8 Wochen beendet sein.Die Anwendung von MabThera wird bei Methotrexat-naiven Patienten nicht empfohlen, da ein günstiges Nutzen-Risiko-Verhältnis nicht bewiesen wurde.ANCA-assoziierte VaskulitisDie Behandlung sollte nur von in der Behandlung rheumatischer und immunologischer Erkrankungen erfahrenen Ärzten durchgeführt werden.Die empfohlene Dosierung von MabThera zur Behandlung der ANCA-assoziierten Vaskulitis beträgt 375 mg/m2 Körperoberfläche, verabreicht einmal wöchentlich als intravenöse Infusion während 4 Wochen.Zur Behandlung der schweren Symptome einer Vaskulitis wird in Kombination mit MabThera die Verabreichung von täglich 1'000 mg Methylprednisolon intravenös während 1 bis 3 Tagen empfohlen, gefolgt von 1 mg/kg Körpergewicht/Tag oralem Prednison (maximal 80 mg/Tag und entsprechend dem klinischen Bedarf so rasch wie möglich auszuschleichen), während und nach der Behandlung mit MabThera.Bei Patienten mit ANCA-assoziierter Vaskulitis wird bei Bedarf während und nach der Behandlung mit MabThera eine Pneumocystis jiroveci Pneumonie (PCP)-Prophylaxe empfohlen.Spezielle DosierungsanweisungenAnwendung bei Kindern und JugendlichenDie Anwendung und Sicherheit von MabThera bei Kindern und Jugendlichen ist bisher nicht geprüft worden.Betagte PatientenBei betagten Patienten (>65 Jahre) ist keine Dosisanpassung erforderlich.Patienten mit Leber- oder NiereninsuffizienzÜber Patienten mit Leber- oder Niereninsuffizienz liegen keine Erfahrungen vor.KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.Patienten mit schwerer Herzinsuffizienz (NYHA-Stadium IV). Rituximab in Kombination mit Chemotherapie inklusive Methotrexat während der Schwangerschaft und Stillzeit.Warnhinweise und VorsichtsmassnahmenProgressive multifokale LeukoenzephalopathieWährend oder nach der Anwendung von MabThera sind Fälle von progressiver multifokaler Leukoenzephalopathie (PML) gemeldet worden. Darüber hinaus wurden in einer klinischen Phase III-Studie zwei Fälle einer tödlich verlaufenden PML bei NHL-Patienten erfasst, die nach Fortschreiten der Krankheit und Wiederbehandlung aufgetreten waren. Die Mehrzahl der Patienten hatten MabThera in Kombination mit einer Chemotherapie oder im Rahmen einer Transplantation hämatopoetischer Stammzellen erhalten. Bei der Differenzialdiagnose von Patienten, die neurologische Symptome entwickeln, ist an die Möglichkeit einer PML zu denken.Die Patienten müssen in regelmässigen Abständen hinsichtlich neu auftretender oder sich verschlimmernder Symptome, die auf eine PML hinweisen können, überwacht werden. Eine PML verläuft oftmals tödlich und resistent gegenüber sämtlichen Therapien. Die Symptome der PML sind vielfältig, schreiten über Tage bis Wochen fort und können zunehmende Schwäche einer Körperseite oder Ungeschicklichkeit der Gliedmassen, Gleichgewichtsstörungen, Sehstörungen sowie Veränderungen des Denkens, des Gedächtnisses und der Orientierung umfassen, die zu Verwirrung und Persönlichkeitsveränderungen führen.Im Zweifelsfall sind weitere Untersuchungen einschliesslich MRT-Aufnahmen, vorzugsweise mit Kontrastmittel, Untersuchung des Liquors auf JC-Virus-DNA und wiederholter neurologischer Beurteilungen in Betracht zu ziehen. Der Arzt sollte auf Symptome achten, die auf eine PML hinweisen, insbesondere solche, die der Patient nicht bemerkt (z.B. kognitive, neurologische oder psychiatrische Symptome). Den Patienten sollte ausserdem geraten werden, ihren Partner oder ihre Pflegepersonen über ihre Behandlung zu informieren, da diese vielleicht Symptome bemerken, die der Patient selbst nicht wahrnimmt.Wenn eine PML vermutet wird, sollte unverzüglich eine neurologische Abklärung erfolgen und die Therapie unterbrochen werden bis eine PML ausgeschlossen ist. Wenn eine PML besteht, muss MabThera dauerhaft abgesetzt werden.Im Anschluss an eine Rekonstitution des Immunsystems ist bei immunsupprimierten Patienten mit PML eine Stabilisierung oder Verbesserung beobachtet worden. Es ist nicht bekannt, ob ein früher Nachweis einer PML und das Aussetzen der Therapie mit MabThera zu einer vergleichbaren Stabilisierung oder Verbesserung führen können.Patienten mit hämatologischen malignen SystemerkrankungenTumorlysesyndromMabThera vermittelt die rasche Lyse benigner und maligner CD20-positiver Zellen und kann ein Tumorlysesyndrom mit Hyperurikämie, Hyperkaliämie, Hypokalzämie, Hyperphosphatämie, erhöhten LDH-Spiegeln und akuter Niereninsuffizienz auslösen. Patienten mit einer grossen Zahl [>25'000/mm3] maligner Zellen im Kreislauf oder mit hoher Tumorbelastung (Läsionen >10 cm), bei denen ein erhöhtes Risiko bezüglich eines Tumorlysesyndroms besteht, sollten mit äusserster Vorsicht behandelt werden. Bei Patienten mit Risiko für die Entwicklung eines Tumorlysesyndroms sollte eine entsprechende Prophylaxe in Erwägung gezogen werden. Bei diesen Patienten sollte im ersten Zyklus, sowie in allen nachfolgenden Zyklen falls die Lymphozytenzahl weiterhin >25'000/mm3 beträgt, die Infusionsgeschwindigkeit reduziert oder die Infusion auf zwei Tage verteilt werden. Die Patienten sollten während der Verabreichung der ersten Infusion besonders eng überwacht werden.InfusionsreaktionenDie Behandlung mit MabThera führt zur Freisetzung von Zytokinen und ist insbesondere bei der ersten Verabreichung mit IRRs assoziiert. Die Inzidenz der IRRs sank von 77% (7% Grad 3 und 4) bei der ersten Infusion zu ungefähr 30% (2% Grad 3 und 4) bei der vierten Infusion und zu 14% (kein Grad 3 und 4 Ereignis) bei der achten Infusion. Schwere IRRs können klinisch eventuell nicht von Überempfindlichkeitsreaktionen oder dem Zytokinfreisetzungssyndrom unterschieden werden. Über schwere IRRs mit letalem Ausgang ist berichtet worden. Schwere IRRs, charakterisiert durch pulmonale Ereignisse, setzten üblicherweise innerhalb von 30 Minuten bis 2 Stunden nach Beginn der ersten MabThera-Infusion ein und umfassten in einigen Fällen auch eine rasche Tumorlyse und Kennzeichen eines Tumorlysesyndroms zusätzlich zu Fieber, Schüttelfrost, Rigor, Hypotonie, Urtikaria, Angioödem und weiteren Symptomen (siehe «Unerwünschte Wirkungen»).Es wird angeraten, IRRs mit Diphenhydramin und Paracetamol/Acetaminophen zu behandeln. Eine Zusatzbehandlung mit Bronchodilatatoren oder intravenöser Kochsalzlösung kann angezeigt sein. In den meisten Fällen kann die Infusion mit einer um 50% verringerten Geschwindigkeit (z.B. von 100 mg/Stunde auf 50 mg/Stunde) fortgesetzt werden, nachdem die Symptome vollständig abgeklungen sind. Die meisten Patienten konnten, wenn nicht lebensbedrohliche IRRs aufgetreten sind, den Therapiezyklus mit MabThera zu Ende führen. Die Weiterbehandlung von Patienten nach vollständigem Abklingen von Anzeichen und Symptomen hat selten zu erneuten schweren IRRs geführt.Es ist über anaphylaktische Reaktionen und andere Überempfindlichkeitsreaktionen nach intravenöser Verabreichung von Proteinen an Patienten berichtet worden. Für den Fall einer Überempfindlichkeitsreaktion auf MabThera sollten Epinephrin, Antihistaminika und Glukokortikoide für den sofortigen Einsatz zur Verfügung stehen.Pulmonale EreignisseAls pulmonale Ereignisse sind Hypoxie, Lungeninfiltrate und akute respiratorische Insuffizienz aufgetreten. Manchen dieser Ereignisse gingen schwere Bronchospasmen und Dyspnoe voraus. In einigen Fällen fand im Lauf der Zeit eine Verschlimmerung der Symptomatik statt, während in anderen Fällen auf eine anfängliche Besserung eine klinische Verschlechterung folgte. Patienten mit pulmonalen Ereignissen oder anderen schweren IRRs sind daher bis zum vollständigen Abklingen ihrer Symptome engmaschig zu überwachen. Bei Patienten mit anamnestisch erhobener Lungeninsuffizienz oder mit pulmonaler Tumorinfiltration besteht ein grösseres Risiko eines ungünstigen Ausganges, und solche Patienten sind daher mit erhöhter Vorsicht zu behandeln. Eine akute respiratorische Insuffizienz kann von Ereignissen wie einer auf dem Thoraxröntgenbild sichtbaren pulmonalen interstitiellen Infiltration oder Ödemen begleitet sein. Das Syndrom tritt in der Regel innerhalb von ein bis zwei Stunden nach Beginn der ersten Infusion auf. Bei Patienten mit schweren pulmonalen Ereignissen muss die Infusion sofort abgebrochen und eine symptomatische Behandlung eingeleitet werden.Herz-KreislaufDa es während der MabThera-Infusion zu vorübergehendem Blutdruckabfall kommen kann, sollte erwogen werden, antihypertensive Medikationen gegebenenfalls 12 Stunden vor der Infusion für die Dauer der Infusion zu unterbrechen. Bei der Verabreichung von MabThera sind Fälle beobachtet worden, bei denen eine vorbestehende ischämische Herzerkrankung manifest wurde und zu Symptomen wie Angina pectoris und Myokardinfarkt sowie Vorhofflimmern und Vorhofflattern führte. Patienten mit Herzerkrankungen in der Anamnese (z.B. Angina pectoris, Herzarrhythmien wie Vorhofflattern und -flimmern, Herzinsuffizienz oder Myokardinfarkt) sollten während der Infusion engmaschig.用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 美罗华冻干粉注射剂Rituximab(Mabthera 1400mg)
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 美罗华冻干粉注射剂Rituximab(Mabthera 1400mg)