盐酸表柔比星注射剂(Epirubicin Sandoz 50mg/25ml)
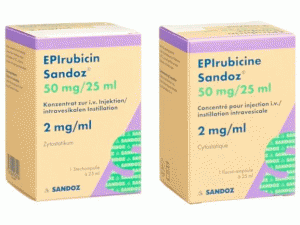 产地国家:瑞士
产地国家:瑞士
处方药:是
所属类别: 50毫克/25毫升/瓶
包装规格: 50毫克/25毫升/瓶
计价单位:瓶
生产厂家英文名:Sandoz Pharmaceuticals AG
原产地英文商品名:Epirubicin Sandoz 50mg/25ml
原产地英文药品名:Epirubicin Hydrochloride
中文参考商品译名:Epirubicin注射剂 50毫克/25毫升/瓶
中文参考药品译名:盐酸表柔比星
简介:
部份中文表柔比星处方资料(仅供参考)
通用名:注射用盐酸表柔比星(表阿霉素)
英文名:Epirubicin Hydrochloride for Injection
成份:艾达生主要成份为盐酸表柔比星。吸收、分布、消除肝肾功能正常的病人静脉注射表阿霉素50-150mg/m2后,广泛分布于组织中。
药代动力学:呈三房室模型-1其 和缓慢终末期,平均半衰期约40小时,艾达生主要代谢产物13-OH衍生物的血浆水平较低。表阿霉素主要在肝脏代谢,经胆汁消除。72小时内,40%的给药量由胆汁排出:48小时内。9-10%的给药量由尿排出。艾达生不通过血脑屏障。
适应症:治疗恶性淋巴瘤、乳腺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
用法用量:
常规剂量:表阿霉素单独用药时成人剂量为60-90mg/m2体表面积,静脉注射,3-5分钟内注入体内。根据病人血象可间隔21天重复使用。
高剂量:若单独使用表阿霉素治疗肺癌时,应按下述方案给药:未经治疗的小细胞肺癌120mg/m2体表面积/日,每三周一次。未经治疗的非小细胞肺癌(鲮状上皮细胞肺癌,大细胞肺癌或肺腺癌):135mg/m2体表面积/日,每三周一次;或455mg/m2体表面积/日,每三周的、二、三天各一次。对因以往化疗、放疗、老年或骨髓造血功能不良的病人,可用小剂量(即常规剂量的60-75mg/m2体表面积)治疗。每个疗程的总量分2-3次使用。由于表阿霉素经肝胆系统排泄,故肝功能不全者应减量,以免蓄积中毒。中度肝功能受损患者(胆红素1.4-3mg/100ml或BPS滞留量9-15%),药量应减少50%,重度肝功能受损者(胆红素>3mg/100ml或BPS滞留量>15%),药量应减少75%。中度肾功能受损者无需减少剂量,因为仅少量的 药物经肾脏排出。用法为静脉给药。建议先注入生理盐水检查输液管及注射针头确实在静脉内之后,在经此通畅的输液管给药。这一方法可减少药物外溢的危险,并确保给药后静脉用盐水冲洗。表阿霉素注射时溢出会造成组织的严重损伤甚至坏死。小静脉注射或反复注射同一血管会造成静脉硬化。表阿霉素不可与肝素混合,因为二者化学性质不配伍,在一定浓度时会发生沉淀反应。表阿霉素可与其他抗肿瘤药物合用,但表阿霉素用量应减低,不应在同一注射器中混合药物。
不良反应:除骨髓抑制和心脏毒性的副作用外,还有以下几种不良反应:脱发,60-90%的病列可发生,一般可逆;男性有胡须生长受抑。粘膜炎,用药的第5-10天出现,通常发生在舌侧及舌下粘膜。高热。肠胃功能紊乱、寒颤、荨麻疹等过敏反应。
禁忌禁:用于因用化疗或放疗而造成明显骨髓抑制的病人、已用过大剂量蒽环类药物(如阿霉素或柔红霉素)的病人,以及近期或即往有心脏受损病史的病人。
英文版说明书:
Epirubicin Sandoz 50mg/25ml Durchstechflasche 25mlFachinformationenZusammensetzungWirkstoff: Epirubicini hydrochloridum.Hilfsstoffe: Natrii chloridum, aqua ad iniectabilia q.s. ad solutionem.Galenische Form und Wirkstoffmenge pro EinheitKonzentrat zur Injektion/Instillation 2 mg/mlDurchstechflasche mit 10 mg/5 ml, 50 mg/25 ml, 100 mg/50 ml, 200 mg/100 ml.Indikationen/AnwendungsmöglichkeitenAdjuvante Behandlung des frühen Mammakarzinoms.Behandlung des fortgeschrittenen Mammakarzinoms.Behandlung bei malignem Lymphom, Weichteilsarkom, Magenkarzinom, Bronchialkarzinom, Ovarialkarzinom.Intravesikale Instillation zur Behandlung sowie zur Rezidivprophylaxe von oberflächlichen papillomatösen Harnblasenkarzinomen nach transurethraler Resektion.Dosierung/AnwendungDas Präparat darf in jedem Fall nur unter der Leitung eines erfahrenen Spezialisten angewendet werden.Epirubicin Sandoz wird als intravenöse Injektion oder intravesikale Instillation verabreicht, siehe «Sonstige Hinweise/Hinweise für die Handhabung».Für die intravenöse Verabreichung wird die Dosierung auf Basis der Körperoberfläche berechnet. Die gesamte Dosis pro Zyklus kann über 2 Tage verteilt werden.Der Dosierungsplan sollte die Knochenmarktoxizität (Leukopenie) berücksichtigen. Insbesondere die dosisintensivierte Behandlung erfordert eine engmaschige Überwachung der Patienten wegen möglicher Komplikationen aufgrund der starken Myelosuppression. Die Blutwerte normalisieren sich in der Regel innerhalb von 21 Tagen nach der Verabreichung. Normalisiert sich das Blutbild innerhalb dieser Periode nicht, muss gegebenenfalls die Dosis reduziert oder das Dosierungsintervall verlängert werden.Wenn Epirubicin in Kombination mit anderen zytotoxischen Substanzen mit überlappender Toxizität verabreicht wird, sollte die empfohlene Dosis pro Zyklus entsprechend reduziert werden. Eine niedrigere Dosis wird besonders bei Patienten empfohlen, deren Knochenmarksfunktion durch eine vorangegangene Chemotherapie oder Strahlentherapie beeinträchtigt wurde, sowie bei älteren Patienten (siehe «Spezielle Dosierungsanweisungen»).Adjuvante Therapie des frühen Mammakarzinoms mit LymphknotenbefallIn Kombinationstherapie mit anderen Zytostatika beträgt die Dosierung von Epirubicin 100−120 mg/m² Körperoberfläche i.v. alle 3−4 Wochen.Therapie des fortgeschrittenen MammakarzinomsIm Allgemeinen beträgt die empfohlene Dosierung von Epirubicin für Erwachsene 75−120 mg/m² Körperoberfläche i.v. alle 3 Wochen in Kombinationstherapie mit anderen Zytostatika. Falls eine Kombinationstherapie nicht in Frage kommt, wird eine Monotherapie mit einer Epirubicin-Dosis von 135 mg/m² Körperoberfläche i.v. alle 3 Wochen empfohlen.Sonstige IndikationsgebieteIm Allgemeinen beträgt die empfohlene Dosierung von Epirubicin 75−90 mg/m² Körperoberfläche i.v.. Diese Dosis kann in 21-Tage-Intervallen wiederholt werden. Nähere Angaben siehe Dosierungsschemata der Kombinationstherapien.Blaseninstillation beim papillomatösen BlasenkarzinomRezidivprophylaxe nach transurethraler Resektion:Instillation von 50 mg Epirubicin in 50 ml physiologischer Kochsalzlösung zunächst 1× wöchentlich über 4 Wochen, dann 1× monatlich über 11 Monate.Therapie bei oberflächlichem Blasenkarzinom:Instillation von 50 mg Epirubicin in 50 ml physiologischer Kochsalzlösung 1× wöchentlich während 8 Wochen.Bei lokaler Unverträglichkeit ist die Dosis auf 30 mg Epirubicin in 50 ml physiologischer Kochsalzlösung zu reduzieren.Spezielle DosierungsanweisungenÄltere Patienten, vorbehandelte Patienten, KnochenmarksbefallBei älteren Patienten sowie Patienten mit dosisintensivierter Vorbehandlung und bei Knochenmarksbefall wird üblicherweise eine Epirubicin-Dosis von 60−75 mg/m² (als hohe Dosis 100−120 mg/m²) i.v. empfohlen.PädiatrieDaten zur Wirksamkeit und Sicherheit bei pädiatrischen Patienten liegen nicht vor.Eingeschränkte LeberfunktionWeil der Wirkstoff hauptsächlich hepatobiliär ausgeschieden wird, muss die i.v. Dosierung bei Patienten mit eingeschränkter Leberfunktion reduziert werden (siehe «Pharmakokinetik/Kinetik spezieller Patientengruppen»). Bei folgenden Leberwerten ist eine Dosisreduktion empfohlen:Bilirubin 21−51 µmol/l oder AST 2−4× höher als der obere Normalwert: Dosisreduktion um ca. 50%.Bilirubin >51 µmol/l oder AST >4× höher als der obere Normalwert: Dosisreduktion um ca. 75%.Patienten mit schwerer Leberfunktionsstörung sollen kein Epirubicin erhalten (siehe «Kontraindikationen»).Eingeschränkte NierenfunktionDas Serumkreatinin sollte vor und während der Behandlung kontrolliert werden. Bei einer schweren Nierenfunktionsstörung (Serumkreatininwert >5 mg/dl) sollte die Dosis angepasst werden (siehe «Pharmakokinetik/Kinetik spezieller Patientengruppen»).KontraindikationenBei i.v. ApplikationSchwangerschaft und Stillzeit.Hämaturie.Ausgeprägte Knochenmarksdepression infolge einer vorangegangenen Chemotherapie oder Strahlentherapie.Aktuelle oder vorbestehende bekannte akute Herzerkrankung.Behandlung mit maximalen kumulativen Dosen von Epirubicin und/oder anderen Anthrazyklinen bzw. Anthracendionen.Generalisierte Infektionen.Schwere Leberfunktionsstörung.Überempfindlichkeit gegenüber Epirubicin, anderen Anthrazyklinen, Anthracendionen oder einem der Hilfsstoffe.Bei BlaseninstillationEs gelten grundsätzlich die gleichen Kontraindikationen wie für die i.v. Applikation, obwohl die systemisch resorbierte Menge nur einer Fraktion der instillierten Dosis entspricht (siehe «Pharmakokinetik»).Weitere Kontraindikationen sind: Harnwegsinfektionen, Entzündungen der Harnblase und Katheterisierungsprobleme.Warnhinweise und VorsichtsmassnahmenDie Behandlung mit Epirubicin sollte in einer Klinik oder in Kooperation mit einer Klinik und nur unter der Aufsicht von entsprechend qualifizierten Ärzten erfolgen. Die Anwendung ist streng nach Vorschrift durchzuführen. Vor Beginn einer Behandlung mit Epirubicin sollten die Nebenwirkungen einer vorhergegangenen Behandlung wie Stomatitis, Neutropenie, Thrombozytopenie und generalisierte Infektionen abgeklungen sein. Im Besonderen sollte bei Therapie mit hohen Dosen auf klinische Komplikationen infolge starker Myelosuppression geachtet werden.HämatologieNach der i.v. Applikation sollten hämatologische Kontrollen regelmässig durchgeführt werden, um die Möglichkeit einer Knochenmarksdepression abzuklären. Eine dosisabhängige, reversible Leukopenie und/oder Granulozytopenie (Neutropenie) sind die vorherrschenden Manifestationen der Epirubicin-Toxizität und der häufigste Grund für eine Dosisbegrenzung. Leukopenie und Neutropenie können insbesondere bei hohen Dosen schwerwiegend sein. Der Nadir wird in den meisten Fällen zwischen dem 10. und 14. Tag nach der Gabe erreicht. In den meisten Fällen erholen sich die Leukozytenwerte und die Neutrophilenzahlen bis zum 21. Tag nach Injektion. Thrombozytopenie und Anämie können ebenfalls auftreten. Klinische Folgen einer schweren Myelosuppression sind Fieber, Infektionen, Sepsis/Septikämie, septischer Schock, Hämorrhagien, Gewebshypoxie oder Tod.SekundärleukämieÜber das Auftreten einer sekundären akuten myeloischen Leukämie mit oder ohne präleukämische Phase wurde vereinzelt berichtet bei Patienten, die gleichzeitig mit Doxorubicin oder Epirubicin in Kombination mit DNA-schädigenden antineoplastischen Wirkstoffen behandelt wurden. Dieses Risiko mag möglicherweise ansteigen, wenn gleichzeitig auch hämatopoetische Wachstumsfaktoren eingesetzt werden oder wenn eine Kombination mit Radiotherapie erfolgt. Diese Fälle können eine kurze Latenzperiode haben (1–3 Jahre).Tumorlyse-Syndrom/HyperurikämieEpirubicin kann gelegentlich eine Hyperurikämie als Folge des Purinabbaus induzieren, ausgelöst durch den raschen Zerfall der neoplastischen Zellen. Daher sollten die Harnsäurespiegel unter Epirubicin überwacht und bei Erhöhung eine entsprechende Therapie eingeleitet werden.HerzfunktionSpezielle Vorsicht ist geboten betreffend der mit Epirubicin assoziierten Kardiotoxizität, welche sich als Soforttyp oder Spättyp manifestieren kann.Soforttyp:Die frühe Form der Kardiotoxizität tritt akut während der Behandlung auf (meist 24−48 Stunden nach Einleitung der Therapie) und manifestiert sich hauptsächlich als Sinustachykardien und/oder EKG-Abweichungen wie unspezifische Änderungen der ST-Strecke. Es wurde über Tachyarrhythmien einschliesslich vorzeitiger ventrikulärer Kontraktionen, Kammertachykardie und Bradykardie wie über AV- und Linksschenkelblock berichtet. Diese sind selten von klinischer Bedeutung und führen nicht generell zum Abbruch der Epirubicinbehandlung.Spättyp:Die verzögerte Form der Kardiotoxizität kann im späteren Verlauf einer Therapie oder 2−3 Monate beziehungsweise sogar erst mehrere Monate oder Jahre nach Abschluss der Therapie in Form einer Kardiomyopathie auftreten. Diese manifestiert sich durch eine Reduktion der LVEF (left ventricular ejection fraction), Niedervoltage und QT-Verlängerung, und/oder als dekompensierte Herzinsuffizienz mit Symptomen wie Dyspnoe, Lungenödem, Stauungsödeme, Kardiomegalie und Hepatomegalie, Oligurie, Ascites, Pleuraerguss und Galopprhythmus.Subakute Effekte wie Perikarditis/Myokarditis wurden ebenfalls beobachtet. Eine lebensbedrohliche Herzinsuffizienz ist die schwerste Form der anthrazyklininduzierten Kardiomyopathie und stellt die kumulative dosislimitierende Toxizität der Substanz dar.Überwachung der Herzfunktion:Die Herzfunktion sollte vor Beginn der Behandlung erfasst und während der gesamten Behandlungsdauer überwacht werden, um das Risiko einer schweren Herzschädigung zu verringern. Die Überwachung der Herzfunktion muss besonders strikt bei Patienten durchgeführt werden, die hohe kumulative Dosen erhalten oder bei denen Risikofaktoren vorhanden sind. Jedoch kann die Kardiotoxizität auch bei niedrigen Dosierungen auftreten und unabhängig von dem Vorhandensein von Risikofaktoren.Die Therapie sollte bei ersten Anzeichen einer Funktionsstörung sofort abgesetzt werden, besonders bei kumulativen Dosen von >600 mg/m2.Eine angemessene quantitative Methode zur wiederholten LVEF-Bestimmung stellt die Multigate Radionuclid-Angiographie (MUGA) oder die Echokardiographie (ECHO) dar.Bei Kindern muss die Herzfunktion langfristig und in regelmässigen Abständen überprüft werden.Kumulative Gesamtdosis:Das Risiko für eine dekompensierte Herzinsuffizienz erhöht sich schnell mit steigender kumulativer Gesamtdosis von Epirubicin. Eine kumulative Dosis Epirubicin von 900 mg/m² sollte nur mit äusserster Vorsicht überschritten werden. Bei der Epirubicin-Dosis sollte eine frühere oder gleichzeitige Therapie mit anderen Anthrazyklinen wie Doxorubicin, Idarubicin, Daunorubicin oder Anthracen-Derivaten berücksichtigt werden. Besonders Patienten, die bereits kumulative Dosen von 500 mg/m2 Doxorubicin oder Daunorubicin erhalten haben, sind gefährdet, eine Herzinsuffizienz zu entwickeln. Es ist anzunehmen, dass sich die Toxizität von Epirubicin und anderen Anthrazyklinen addiert.Risikofaktoren:Risikofaktoren für eine Kardiotoxizität sind manifeste oder latente kardiovaskuläre Erkrankungen, früher oder gleichzeitig erfolgte Bestrahlung der mediastinalen/pericardialen Region, vorausgegangene Therapie mit anderen Anthrazyklinen oder Anthracendionen sowie gleichzeitige Gabe von Arzneimitteln, die die Herzkontraktion herabsetzen können oder deren Anwendung mit einer Kardiotoxizität assoziiert wird (z.B. Trastuzumab).Anthrazykline, einschliesslich Epirubicin, sollten nur bei gleichzeitiger engmaschiger Überwachung der Herzfunktion des Patienten mit anderen kardiotoxischen Substanzen verabreicht werden. Das Risiko für eine kardiotoxische Wirkung von Anthrazyklinen könnte auch nach dem Absetzen anderer kardiotoxischer Arzneimittel erhöht sein, insbesondere wenn diese eine lange Halbwertszeit aufweisen. Die Halbwertszeit von Trastuzumab beträgt ungefähr 28−38 Tage und die Substanz kann bis zu 27 Wochen im Blut vorhanden sein. Während dieser Zeit sollte eine Therapie mit Anthrazyklinen daher vermieden oder nur unter sorgfältiger Überwachung der Herzfunktion durchgeführt werden.Durch die Glucuronidierung von Epirubicin und Epirubicinol ist die Kardiotoxizität begrenzt (siehe «Pharmakokinetik»). Bei Patienten mit Glucuronidierungsstörungen sollte daher die Herzfunktion besonders kontrolliert werden.Leber- und NierenfunktionVor Behandlungsbeginn und wenn möglich während der Behandlung müssen die Leberfunktionswerte bestimmt werden (AST, ALT, alkalische Phosphatase, γ-GT, Bilirubin). Das Serumkreatinin ist vor und während der Therapie zu messen.Reaktionen an der Injektionsstelle, ExtravasationEpirubicin Sandoz darf nur intravasal appliziert werden. Paravenöse Fehlinjektion kann zu lokalen Schmerzen, schweren Gewebeläsionen (Vesikation, schwere Cellulitis), lokaler Nekrose und Thrombophlebitis führen. Wird das Präparat vorschriftsgemäss appliziert, ist das Risiko einer Thrombophlebitis an der Einstichstelle minimal.Immunsupprimierender EffektDie Verabreichung von Lebend- oder attenuierten Impfstoffen bei durch eine Chemotherapie (einschliesslich Epirubicin) immunsupprimierten Patienten kann schwere oder fatale Infektionen verursachen. Die Immunisierung mit Lebendimpfstoffen sollte bei Patienten unter Epirubicin vermieden werden.Bei Verwendung von inaktiven oder Tot-Impfstoffen ist zu berücksichtigen, dass der Impfschutz vermindert sein kann.SonstigesEpirubicin kann Amenorrhoe oder eine vorzeitige Menopause bei prämenopausalen Frauen hervorrufen.Intravesikale VerabreichungBei Blaseninstillationen gelten grundsätzlich die gleichen Vorsichtsmassnahmen, obwohl die systemisch resorbierte Menge nur einer Fraktion der instillierten Dosis entspricht.Epirubicin Sandoz sollte nicht zur Behandlung bei invasiven Tumoren, die die Blasenwand durchbrochen haben, verwendet werden (siehe «Indikationen/Anwendungsmöglichkeiten»).InteraktionenEpirubicin wird hauptsächlich in Kombination mit anderen Zytostatika verwendet. Die Toxizität kann additiv sein, besonders in Bezug auf Knochenmark/Hämatologie und gastrointestinale Effekte (siehe «Warnhinweise und Vorsichtsmassnahmen»).Die gleichzeitige Gabe von Epirubicin und anderen kardiotoxisch wirkenden Arzneimitteln (z.B. 5-Fluorouracil und/oder Cyclophosphamid) wie auch die gleichzeitige Gabe von herzaktiven Präparaten (z.B. Kalziumantagonisten) erfordern besondere Aufmerksamkeit gegenüber der Herzaktion während der gesamten Behandlung.Cimetidin erhöht die AUC von Epirubicin um 50% und sollte während einer Epirubicin-Therapie nicht verabreicht werden.Bei gleichzeitiger Verabreichung von Epirubicin mit Inhibitoren der Glucuronidierung sollte die Herzfunktion sorgfältig überwacht werden (siehe «Pharmakokinetik»).Schwangerschaft/StillzeitSchwangerschaftStudien bei Tieren haben eine Schädigung des Foetus gezeigt, bzw. es gibt Hinweise auf fötale Risiken, basierend auf Erfahrungen bei Tieren, wobei die Risiken die möglichen positiven therapeutischen Effekte bei weitem übersteigen. Dieses Arzneimittel ist in der Schwangerschaft kontraindiziert. Frauen im gebärfähigen Alter sollten während einer Behandlung eine sichere Kontrazeption betreiben.Wegen der genotoxischen, mutagenen Aktivität von Epirubicin, welche Chromosomenschäden bei Spermatozoen verursachen kann, muss auch während einer Behandlung beim Mann eine sichere Kontrazeption betrieben werden.StillzeitDas Arzneimittel ist kontraindiziert.Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs liegen keine gezielten Untersuchungen über einen Einfluss von Epirubicin auf die Fahrtüchtigkeit oder das Bedienen von Maschinen vor.Unerwünschte WirkungenNach parenteraler GabeKnochenmarksdepression und Kardiomyopathien sind die schwerwiegendsten unerwünschten Wirkungen.Das Profil der Nebenwirkungen bei hohen Dosen (>90 mg/m² alle 3−4 Wochen) von Epirubicin entspricht demjenigen bei tieferen Dosen (<90 mg/m² alle 3−4 Wochen), jedoch nimmt die Häufigkeit einer schweren Neutropenie und Stomatitis/Mukositis mit Erhöhung der Dosis zu.Die unerwünschten Wirkungen sind nach Organklasse aufgeführt und nach Häufigkeitsgrad gewichtet, unter Berücksichtigung folgender Definitionen: sehr häufig (≥1/10), häufig (<1/10, ≥1/100), gelegentlich (<1/100, ≥1/1000), selten (<1/1000, ≥1/10'000), sehr selten (<1/10'000), Einzelfälle (Häufigkeit ist auf Grundlage der verfügbaren Daten nicht abschätzbar). «Post-Marketing Erfahrung»: Die Daten aus der Post-Marketing Erfahrung beschreiben die weltweit spontan gemeldeten, in der Literatur beschriebenen und von den Behörden gemeldeten unerwünschten Wirkungen. Sie sind in nachfolgender Auflistung mit (*) gekennzeichnet.Infektionen und parasitäre ErkrankungenSehr häufig: Infektionen* (26.1%), Konjunktivitis (14.8%).Gelegentlich: Pneumonie*, Sepsis.Gutartige, bösartige und unspezifische Neubildungen (einschliesslich Zysten und Polypen)Gelegentlich: Akute myeloische Leukämie, akute lymphatische Leukämie.Erkrankungen des Blutes und des LymphsystemsSehr häufig: Anämie (99.3%), Leukopenie (97.2%), Thrombozytopenie (97.2%), Neutropenie (95.8%).Häufig: Febrile Neutropenie.Erkrankungen des ImmunsystemsGelegentlich: Anaphylaktische Reaktion*.Stoffwechsel- und ErnährungsstörungenHäufig: Verminderter Appetit.Gelegentlich: Dehydratation*, Hyperurikämie*.AugenerkrankungenSehr häufig: Keratitis (14.8%).HerzerkrankungenHäufig: Verkleinerte Auswurffraktion, ventrikuläre Tachykardie, atrioventrikulärer Block, Linksschenkelblock, Bradykardie, dekompensierte Herzinsuffizienz.Gelegentlich: Kardiomyopathie, EKG-Veränderungen, Sinustachykardie, Tachyarrhythmie, Galopprhythmus.GefässerkrankungenSehr häufig: Hitzewallung (38.9%), Phlebitis* (10.7%).Häufig: Hämorrhagie, Hitzegefühl*.Gelegentlich: Arterielle Embolie* (einschliesslich Lungenembolie*), Thrombophlebitis*, Schock*.Erkrankungen des GastrointestinaltraktsSehr häufig: Nausea (92.4%), Erbrechen (92.4%), Stomatitis (58.6%), Mukositis (45%), Diarrhoe (24.8%).Häufig: gastrointestinale Schmerzen*, gastrointestinale Erosion*, Gastrointestinalulkus*.Gelegentlich: Gastrointestinale Blutung, Hyperpigmentierung der oralen Schleimhaut*.Leber- und GallenerkrankungenSehr häufig: anomale Transaminasen (95.6%).Häufig: Bilirubinerhöhung.Erkrankungen der Haut und des UnterhautzellgewebesSehr häufig: Alopezie (95.5%), Hauttoxizität (19.5%).Häufig: Rash/Pruritus, Hautüberpigmentation (Nagelbett, entlang der zur Infusion benutzten Vene oder generalisiert)*, Hautveränderungen (4.7%), Fotosensibilität*, Überempfindlichkeit des Bestrahlungsfeldes («radiation recall reaction»).Gelegentlich: Urtikaria*, Erythem*.Erkrankungen der Nieren und HarnwegeHäufig: Arzneimittelbedingte Rotfärbung des Urins in den ersten 1–2 Behandlungstagen*.Erkrankungen der Geschlechtsorgane und der BrustdrüseSehr häufig: Amenorrhoe (71.8%; bei prämenopausalen Frauen, siehe «Warnhinweise und Vorsichtsmassnahmen»).Allgemeine Erkrankungen und Beschwerden am VerabreichungsortSehr häufig: Unwohlsein (40.1%), Fieber* (26.1%).Häufig: Schüttelfrost*.Gelegentlich: Asthenie.Einzelfälle von Extravasation mit Vesikation, schwerer Cellulitis und Nekrose.Nach BlaseninstillationDa in der Regel eine sehr geringe Menge der aktiven Substanz (Epirubicin) nach einer Blaseninstillation resorbiert wird (siehe «Pharmakokinetik»), kommt es kaum zu schweren systemisch bedingten unerwünschten Wirkungen.Sehr häufig: chemische Zystitis* (32%).Häufig: lokale Reaktionen wie Brennen und Pollakisurie.Gelegentlich: bakterielle Zystitis.Selten: allergische Erscheinungen.ÜberdosierungSehr hohe Einzeldosen von Epirubicin können innert 24 Stunden zu Degenerationen des Myokards führen und innert 10 bis 14 Tagen zu schwerer Knochenmarksdepression. Die Behandlung sollte unterstützende Massnahmen umfassen wie Blut-Transfusionen und keimfreie Räume. Herzinsuffizienz ist bis zu 6 Monate nach der Überdosierung mit Anthrazyklinderivaten festgestellt worden. Die Patienten müssen daher sorgfältig überwacht werden. Bei Auftreten einer Herzinsuffizienz sollte diese konventionell behandelt werden. Überdosierung führt zu toxischen gastrointestinalen Effekten (hauptsächlich Mukositis).Eigenschaften/WirkungenATC-Code: L01DB03Epirubicin ist ein Anthrazyklin-Antibiotikum mit antineoplastischer Wirksamkeit.Es dringt rasch in die Zelle ein, bindet sich an die DNS und hemmt die Nukleinsäuresynthese und Zellteilung über Hemmung der DNS-Topoisomerase II und der DNS-Helicase.PharmakokinetikDie systemische Resorption nach intravesikaler Gabe ist gering. Nach intravesikaler Verabreichung von 30 mg oder 50 mg Epirubicin in 50 ml physiologischer Kochsalzlösung lagen die Epirubicin-Plasmakonzentrationen pro ml im Nanogrammbereich, nahe der Nachweisgrenze.DistributionEpirubicin wird umfassend in die Gewebe verteilt, das Verteilungsvolumen beträgt 32–46 l/kg. Es wird in die Erythrozyten und Leukozyten aufgenommen. Es passiert nicht die Blut-Hirn-Schranke. Die Plasmaproteinbindung beträgt ca. 77%.MetabolismusEpirubicin wird vorwiegend in der Leber metabolisiert. Als Hauptmetaboliten wurden das aktive (10 mal geringer als die Muttersubstanz) Epirubicinol (13-OH-Epirubicin), Aglycone und Glucuronide von Epirubicin und Epirubicinol identifiziert. Die Plasmaspiegel des 13-OH-Derivates liegen tiefer als jene von Epirubicin, der Kurvenverlauf ist jedoch analog.Die 4'-O-Glucuronidierung unterscheidet Epirubicin von Doxorubicin und kann die schnellere Elimination von Epirubicin und seine reduzierte Toxizität erklären.EliminationEpirubicin wird hauptsächlich in Form von Metaboliten über das biliäre System eliminiert. Ca. 40% der applizierten Dosis werden in der 72-h-Galle nachgewiesen, etwa 9−10% werden im Verlauf von 48 Stunden renal ausgeschieden. Die Plasmaspiegel von Epirubicin zeigen einen triphasischen Verlauf. Die Plasma-Clearance beträgt 0,9 l/Min, die terminale Halbwertszeit etwa 40 Stunden.Kinetik spezieller PatientengruppenPatienten mit eingeschränkter LeberfunktionBei Patienten mit Lebermetastasen wurden erhöhte Plasmaspiegel von Epirubicin beobachtet. Bei Patienten mit Grad 2-Erhöhung der Transaminasen und des Bilirubins ist die mediane Plasmaclearance von Epirubicin um ca. 50% erniedrigt. Patienten mit Leberfunktionsstörungen nach Child Pugh wurden nicht untersucht.Patienten mit eingeschränkter NierenfunktionBei Patienten mit Serumkreatinin <5 mg/dl wurden keine signifikanten Änderungen der Pharmakokinetik von Epirubicin oder des Hauptmetaboliten Epirubicinol beobachtet. Bei 4 Patienten mit einem Serumkreatinin ≥5 mg/dl wurde eine 50%-ige Reduktion der Plasmaclearance beobachtet. Für Patienten unter Dialyse gibt es keine Daten.Ältere und pädiatrische PatientenDaten zur Pharmakokinetik bei älteren und pädiatrischen Patienten liegen nicht vor.Präklinische DatenDie LD50 für Epirubicin bei Mäusen und Ratten betrug 29,3 und 14,2 mg/kg und ungefähr 2,0 mg/kg für Hunde. Studien zur Kardiotoxizität (Ratten und Hunde) zeigten bei Epirubicin eine geringere kardiale Toxizität als bei Doxorubicin.Epirubicin erwies sich bei Ratten als karzinogen. Die Substanz zeigte in den meisten in vitro und in vivo Prüfungen mutagene und genotoxische Eigenschaften.Bei Ratten ergaben sich toxische Effekte auf die Reproduktionsorgane und Embryotoxizität; obschon keine foetalen Missbildungen beobachtet wurden, muss Epirubicin (wie andere Anthracycline) als potentiell teratogen angesehen werden.Sonstige HinweiseInkompatibilitätenEpirubicin Sandoz darf nicht mit Heparin gemischt werden, da dieses mit Epirubicin chemisch inkompatibel ist und die Gefahr einer Ausfällung besteht.Epirubicin Sandoz darf mit keinen anderen Lösungen gemischt werden, da bei längerem Kontakt mit Lösungen mit einem alkalischen pH der Wirkstoff hydrolysieren kann.HaltbarkeitDas Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.Besondere LagerungshinweiseIn der Originalverpackung, im Kühlschrank (2−8 °C), vor Licht geschützt und ausser Reichweite von Kindern lagern.Das Präparat darf nicht länger als 24 Stunden bei Raumtemperatur (15−25 °C) und unter Lichtschutz aufbewahrt werden.Die Lagerung von Epirubicin Sandoz im Kühlschrank kann zur Ausbildung eines gelartigen Produkts führen. Dieses bildet sich bei Raumtemperatur (15–25 °C) über zwei bis maximal vier Stunden wieder in eine leicht visköse bis komplett mobile Lösung zurück.Epirubicin enthält kein Konservierungsmittel. Nach Anbruch der Durchstechflasche ist das Konzentrat sofort zu verwenden; falls erforderlich, kann die angebrochene Durchstechflasche maximal 24 Std. im Kühlschrank (2−8 °C) aufbewahrt werden.Die chemische und physikalische Stabilität der verdünnten Lösung für die Blaseninstillation (Konzentration 1 mg/ml) wurde für 24 Std. im Kühlschrank (2−8 °C) und bei Raumtemperatur (15−25 °C) unter Lichtschutz gezeigt. Aus mikrobiologischer Sicht ist die Lösung jedoch sofort zu verwenden; falls erforderlich, kann die Lösung maximal 24 Std. im Kühlschrank (2−8 °C) aufbewahrt werden.Hinweie für die HandhabungVor Anwendung muss Epirubicin Sandoz auf Raumtemperatur gebracht werden.Intravenöse InjektionDie gebrauchsfertige Injektionslösung wird in den Schlauch einer frei fliessenden intravenösen Infusion von physiologischer Kochsalzlösung oder 5%iger Glucoselösung während 3−20 Min. abhängig von der Dosis und dem Volumen der Infusionslösung injiziert. Im Anschluss daran wird die physiologische Kochsalzlösung bzw. die 5%ige Glucoselösung für 10−15 Min. intravenös infundiert.Diese Technik minimalisiert das Risiko einer Thrombose oder perivenösen Extravasation, die zu schwerster Cellulitis und Nekrose führen kann. Das Präparat soll deshalb nicht in kleine Venen infundiert werden. Venensklerose kann entstehen, wenn wiederholte Injektionen in dieselbe Vene gemacht werden.BlaseninstillationZur intravesikalen Instillation wird 50 mg Epirubicin in 50 ml physiologischer Kochsalzlösung verabreicht. Zu Epirubicin Sandoz 50 mg müssen somit noch 25 ml physiologische Kochsalzlösung beigefügt werden. Die instillierte Lösung muss während mindestens 1 Stunde in der Blase bleiben. Während der Instillation sollte der Patient gelegentlich gedreht werden. Die Blase muss am Ende der Instillation geleert werden. Der Patient soll in den 12 Stunden vor der Behandlung keine Flüssigkeit mehr zu sich nehmen.Handhabung von ZytostatikaBei der Handhabung von Epirubicin Sandoz und der Entsorgung sind die Richtlinien für Zytostatika zu befolgen.Zulassungsnummer56243 (Swissmedic).ZulassungsinhaberinSandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz.
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 盐酸表柔比星注射剂(Epirubicin Sandoz 50mg/25ml)