长春新碱注射剂(Vincristin Injektionslösung)
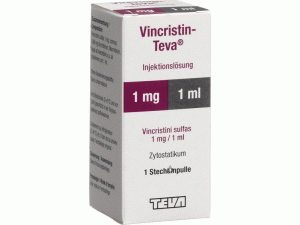 产地国家:瑞士
处方药:是
所属类别: 2毫克/2毫升/瓶
包装规格: 2毫克/2毫升/瓶
计价单位:瓶
生产厂家英文名:Teva Pharma AG
原产地英文商品名:Vincristin Injektionslösung 2mg/2ml/vial
原产地英文药品名:Vincristine
中文参考商品译名:长春新碱 2毫克/2毫升/瓶
中文参考药品译名:长春新碱
药品别名:醛基长春碱、安可平、硫酸长春醛碱、硫酸醛基长春碱、新长春碱、Leurocristine、Oncovin、VCR、Oncovin
药物剂型:注射剂(粉),0.5mg,1mg。
作用机制:与长春碱相似,主要作用于M期,对动物肿瘤的疗效超过长春碱且抗瘤谱广。抑制微管蛋白的聚合,妨碍纺锤体的形成,使有丝分裂停止于中期。还可干扰蛋白质代谢及抑制RNA多聚酶的活力,抑制细胞膜类脂质的合成和氨基酸在细胞膜的转运。由于可使增殖细胞同步化而使其他抗肿瘤药物的疗效增加,故常用于联合化疗的方案中。
药动学:口服吸收极差,静脉给药后迅速分布至各组织。进入肝脏较多,瘤组织可选择性浓集药物。70%由胆道随粪便排泄,约12%由尿中排出。如肝功能不全或胆道梗阻则毒性增加。本品不能通过血脑脊液屏障进入中枢神经系统。
适应证:
1.急性白血病:对各种类型的急性白血病均有效,尤其是急性淋巴细胞白血病疗效突出。
2.恶性淋巴瘤:疗效也较好,但对霍奇金病不如长春碱。
3.其他:如绒毛膜上皮癌、乳腺癌、肾母细胞瘤、神经母细胞瘤、尤文氏瘤、平滑肌肉瘤、肺癌、宫颈癌、蕈样真菌病(蕈样肉芽肿)、恶性黑色素瘤等。
禁忌证:
1.对本药或其他长春花生物碱过敏者;
2.孕妇;
3.Charcot-Marie-Tooth综合征而引起的脱髓鞘患者。
注意事项:
1.慎用:(1)患急性尿酸性肾病者、有痛风病史或有尿酸盐性肾结石病史者;(2)患有神经肌肉性疾病者;(3)肺功能障碍者;(4)近期进行过放射或抗癌药治疗者;(5)有肝功能损害者;(6)有感染者;(7)白细胞减少者;(8)哺乳期妇女;(9)2岁以下儿童。
2.药物对儿童的影响:2岁以下儿童的周围神经髓鞘形成尚不健全,应慎用。
3.药物对妊娠的影响:本药可影响细胞动力学,可致畸、致突变,故孕妇不能使用。
4.药物对检验值或诊断的影响:本药可使血钾升高、血及尿中尿酸升高。
5.用药前后及用药时应当检查或监测:用药期间应定期检查周围血象、肝肾功能。注意观察心率、肠鸣音及肌腱反射等。
6.用药过量会导致严重组织损伤,因此应严格按体表面积计算用量,每次限制在2mg以下。
7.局部刺激性强,注射时避免药液外漏。
8.本药不能肌内、皮下和鞘内注射。
9.本药应避免直射。
不良反应:
1.神经系统毒性:为剂量限制性毒性。以周围神经病变多见,如深反射消失、感觉异常、肌无力,也可见喉神经麻痹、腓神经麻痹、肠麻痹、暂时性尿潴留,严重者出现大小便失禁。中枢神经受累可出现癫痫发作、一过性失明,有鞘内误注导致死亡的报道。
2.消化道反应:恶心、呕吐、腹痛、便秘,严重时出现肠麻痹,这与VCR影响自主神经系统有关。用药前给予轻泻剂及饮足够的水分有助于减轻此症。
3.骨髓抑制:较轻,剂量较大或用药时间长者可出现白细胞和血小板下降。
4.其他:局部刺激、脱发、皮疹、发热、男性生殖功能失常等。
用法用量:
1.成人:静脉注射(临用前加氯化钠注射剂适量,使其溶解)。每次1.0~1.4mg/m2或0.02~0.04mg/kg(不能超过2mg),每周1次,1个疗程总量为20mg。
2.儿童:静脉注射每次0.05~0.075mg/kg,每周1次。
药物相互作用:
1.本药可阻止甲氨蝶呤从细胞内渗出而提高其细胞内浓度,故常先注射本药再用甲氨蝶呤。
2.与门冬酰胺酶、异烟肼合用可加重神经系统毒性;与非格司亭、沙莫司亭合用,可能产生严重的周围神经病。
3.国外资料报道,可增加本药毒性的药物有:奎宁始霉素、齐多夫定(ZIDOVUDINE),合用时可能需要调整本药剂量。
4.本药可改变地高辛的吸收,降低其使用。
5.卡马西平、磷苯妥英钠、苯妥英钠可增加本药的清除而降低其效力。
6.国外资料提示,伊曲康唑可抑制细胞色素P450介导的代谢及P-糖蛋白,从而可增加本药所致的神经毒性和麻痹性肠梗阻。
7.国外资料报道,使用本药时接种活疫苗(如轮状病毒疫苗),可增加活疫苗感染的风险,故使用本药时禁止接种活疫苗,处于缓解期的白血病患者,化疗结束后间隔至少3个月才能接种活疫苗。
8.替尼泊苷与长春新碱合用可增强长春新碱的神经毒性。
9.长春新碱与钙通道阻滞剂如维拉帕米、硝苯地平、尼莫地平等合用,能提高肿瘤细胞对长春新碱的摄取量,并阻滞其外流,使细胞内维持较高浓度,增强抗癌疗效。
临床研究:VCR是较早用于临床目前仍广泛使用的抗癌药之一,对白血病、恶性淋巴瘤、生殖细胞肿瘤、小细胞肺癌等疗效较好,且价格便宜。其骨髓抑制轻微,是血象低下者的首选药物之一。该药有明显的神经毒性,个体差异较大,使用时需注意。一般每次用量不超过2mg。
产地国家:瑞士
处方药:是
所属类别: 2毫克/2毫升/瓶
包装规格: 2毫克/2毫升/瓶
计价单位:瓶
生产厂家英文名:Teva Pharma AG
原产地英文商品名:Vincristin Injektionslösung 2mg/2ml/vial
原产地英文药品名:Vincristine
中文参考商品译名:长春新碱 2毫克/2毫升/瓶
中文参考药品译名:长春新碱
药品别名:醛基长春碱、安可平、硫酸长春醛碱、硫酸醛基长春碱、新长春碱、Leurocristine、Oncovin、VCR、Oncovin
药物剂型:注射剂(粉),0.5mg,1mg。
作用机制:与长春碱相似,主要作用于M期,对动物肿瘤的疗效超过长春碱且抗瘤谱广。抑制微管蛋白的聚合,妨碍纺锤体的形成,使有丝分裂停止于中期。还可干扰蛋白质代谢及抑制RNA多聚酶的活力,抑制细胞膜类脂质的合成和氨基酸在细胞膜的转运。由于可使增殖细胞同步化而使其他抗肿瘤药物的疗效增加,故常用于联合化疗的方案中。
药动学:口服吸收极差,静脉给药后迅速分布至各组织。进入肝脏较多,瘤组织可选择性浓集药物。70%由胆道随粪便排泄,约12%由尿中排出。如肝功能不全或胆道梗阻则毒性增加。本品不能通过血脑脊液屏障进入中枢神经系统。
适应证:
1.急性白血病:对各种类型的急性白血病均有效,尤其是急性淋巴细胞白血病疗效突出。
2.恶性淋巴瘤:疗效也较好,但对霍奇金病不如长春碱。
3.其他:如绒毛膜上皮癌、乳腺癌、肾母细胞瘤、神经母细胞瘤、尤文氏瘤、平滑肌肉瘤、肺癌、宫颈癌、蕈样真菌病(蕈样肉芽肿)、恶性黑色素瘤等。
禁忌证:
1.对本药或其他长春花生物碱过敏者;
2.孕妇;
3.Charcot-Marie-Tooth综合征而引起的脱髓鞘患者。
注意事项:
1.慎用:(1)患急性尿酸性肾病者、有痛风病史或有尿酸盐性肾结石病史者;(2)患有神经肌肉性疾病者;(3)肺功能障碍者;(4)近期进行过放射或抗癌药治疗者;(5)有肝功能损害者;(6)有感染者;(7)白细胞减少者;(8)哺乳期妇女;(9)2岁以下儿童。
2.药物对儿童的影响:2岁以下儿童的周围神经髓鞘形成尚不健全,应慎用。
3.药物对妊娠的影响:本药可影响细胞动力学,可致畸、致突变,故孕妇不能使用。
4.药物对检验值或诊断的影响:本药可使血钾升高、血及尿中尿酸升高。
5.用药前后及用药时应当检查或监测:用药期间应定期检查周围血象、肝肾功能。注意观察心率、肠鸣音及肌腱反射等。
6.用药过量会导致严重组织损伤,因此应严格按体表面积计算用量,每次限制在2mg以下。
7.局部刺激性强,注射时避免药液外漏。
8.本药不能肌内、皮下和鞘内注射。
9.本药应避免直射。
不良反应:
1.神经系统毒性:为剂量限制性毒性。以周围神经病变多见,如深反射消失、感觉异常、肌无力,也可见喉神经麻痹、腓神经麻痹、肠麻痹、暂时性尿潴留,严重者出现大小便失禁。中枢神经受累可出现癫痫发作、一过性失明,有鞘内误注导致死亡的报道。
2.消化道反应:恶心、呕吐、腹痛、便秘,严重时出现肠麻痹,这与VCR影响自主神经系统有关。用药前给予轻泻剂及饮足够的水分有助于减轻此症。
3.骨髓抑制:较轻,剂量较大或用药时间长者可出现白细胞和血小板下降。
4.其他:局部刺激、脱发、皮疹、发热、男性生殖功能失常等。
用法用量:
1.成人:静脉注射(临用前加氯化钠注射剂适量,使其溶解)。每次1.0~1.4mg/m2或0.02~0.04mg/kg(不能超过2mg),每周1次,1个疗程总量为20mg。
2.儿童:静脉注射每次0.05~0.075mg/kg,每周1次。
药物相互作用:
1.本药可阻止甲氨蝶呤从细胞内渗出而提高其细胞内浓度,故常先注射本药再用甲氨蝶呤。
2.与门冬酰胺酶、异烟肼合用可加重神经系统毒性;与非格司亭、沙莫司亭合用,可能产生严重的周围神经病。
3.国外资料报道,可增加本药毒性的药物有:奎宁始霉素、齐多夫定(ZIDOVUDINE),合用时可能需要调整本药剂量。
4.本药可改变地高辛的吸收,降低其使用。
5.卡马西平、磷苯妥英钠、苯妥英钠可增加本药的清除而降低其效力。
6.国外资料提示,伊曲康唑可抑制细胞色素P450介导的代谢及P-糖蛋白,从而可增加本药所致的神经毒性和麻痹性肠梗阻。
7.国外资料报道,使用本药时接种活疫苗(如轮状病毒疫苗),可增加活疫苗感染的风险,故使用本药时禁止接种活疫苗,处于缓解期的白血病患者,化疗结束后间隔至少3个月才能接种活疫苗。
8.替尼泊苷与长春新碱合用可增强长春新碱的神经毒性。
9.长春新碱与钙通道阻滞剂如维拉帕米、硝苯地平、尼莫地平等合用,能提高肿瘤细胞对长春新碱的摄取量,并阻滞其外流,使细胞内维持较高浓度,增强抗癌疗效。
临床研究:VCR是较早用于临床目前仍广泛使用的抗癌药之一,对白血病、恶性淋巴瘤、生殖细胞肿瘤、小细胞肺癌等疗效较好,且价格便宜。其骨髓抑制轻微,是血象低下者的首选药物之一。该药有明显的神经毒性,个体差异较大,使用时需注意。一般每次用量不超过2mg。
英文版说明书:
Vincristin Teva Injektionslösung 2mg/2ml Durchstechflasche 2mlFachinformationenZusammensetzungWirkstoff: Vincristini sulfas 1 mg, corresp. 0,89 mg Vincristinum.Hilfsstoffe: Mannitolum, Aqua ad iniectabilia q.s. ad solutionem pro 1 ml.Ohne Konservierungsstoffe.Galenische Form und Wirkstoffmenge pro EinheitDurchstechflaschen mit Injektionslösung zu 1 mg/1 ml, 2 mg/2 ml und 5 mg/5 ml.Indikationen/AnwendungsmöglichkeitenAkute Leukämie.Kombinationstherapie bei M. Hodgkin, Non-Hodgkin-Lymphom, inklusive Sonderformen, Rhabdomyosarkom, Neuroblastom, Wilms Tumor, osteogenem Sarkom, Ewing Sarkom, malignem Melanom, kleinzelligem Lungenkarzinom, gynäkologischen Tumoren des Kindesalters, Mammakarzinom.Idiopathische thrombozytopenische Purpura (Morbus Werlhof) bei Patienten, die auf eine Splenektomie und Kurzzeitbehandlung mit Corticosteroiden nicht angesprochen haben.Dosierung/AnwendungDie Behandlung mit Vincristin-Teva sollte nur von Ärzten durchgeführt werden, die in der Tumortherapie Erfahrung haben.Vincristin-Teva wird als intravenöse Injektion verabreicht. Angaben zur Verabreichung siehe unter «Sonstige Hinweise/Hinweise für die Handhabung». Folgendes Dosierungsschema wird empfohlen. Für weitere Schemen, insbesondere in der Kombinationstherapie ist die Fachliteratur zu konsultieren.Für Erwachsene beträgt die Dosis 1,0–1,4 mg/m² Körperoberfläche in wöchentlichen Abständen.Bei einer Kombinationstherapie von Vincristin mit L-Asparaginase sollte Vincristin-Teva 12 bis 24 Stunden vor dem Enzym gegeben werden; durch diese Massnahme wird die hepatische Clearance von Vincristin nicht beeinträchtigt.Bei einigen Patienten mit idiopathischer thrombozytischer Purpurea hat eine 3–4 wöchige Behandlung mit Vincristin-Teva in empfohlener wöchentlicher Dosierung zu Dauerremissionen geführt. Wenn sich nach 3–6 Dosen kein Ansprechen abzeichnet, ist ein Erfolg durch weitere Dosen auch nicht wahrscheinlich.Spezielle DosierungsanweisungenFür Kinder und Jugendliche über 10 kg beträgt die Dosis 2 mg/m² Körperoberfläche einmal pro Woche.Kinder, die 10 kg oder weniger wiegen, sollten 0,05 mg/kg Körpergewicht einmal pro Woche erhalten, worauf die weiteren Dosen vorsichtig erhöht werden können.Patienten mit stark eingeschränkter Leberfunktion sollten Anfangsdosen von 0,05 bis 1 mg/m² erhalten. Für Patienten mit einem direkten Serum-Bilirubin-Wert über 3 mg/dl wird initial eine 50%ige Dosisreduktion empfohlen. Anschliessende Dosierungen können je nach Toleranz der Initialdosis hinaufgesetzt werden.Bei Patienten mit Nierenfunktionsstörungen ist keine Dosisanpassung nötig.KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.Vincristin-Teva soll Patienten unter Bestrahlungstherapie nicht verabreicht werden.Charcot-Marie-Tooth-Syndrom.Schwangerschaft und Stillzeit.Warnhinweise und VorsichtsmassnahmenDosierung und neurologische Nebenwirkungen erfordern besondere Aufmerksamkeit, wenn Vincristin-Teva an Patienten mit vorbestehender neurologischer Erkrankung verabreicht wird, und ebenso, wenn auch andere Arzneimittel mit neurotoxischem Potential zur Anwendung kommen.Bei Leukopenie oder infektiösen Komplikationen ist die nächste Dosis erst nach sorgfältiger Beurteilung des Falles zu verabfolgen.Patienten mit eingeschränkter Leberfunktion müssen mit Vorsicht behandelt werden und die Dosis ist allenfalls anzupassen (siehe «Dosierung/Anwendung»). Das gleiche gilt, wenn gleichzeitig mit der Chemotherapie bestrahlt wird und das Bestrahlungsfeld die Leber einschliesst. Gegebenenfalls sollte Vincristin-Teva vorsichtshalber so lange nicht verabreicht werden, bis die Strahlentherapie beendet ist.Akute Kurzatmigkeit (Dyspnoe) und schwerer Bronchospasmus sind nach der Verabreichung von Vinca-Alkaloiden mitgeteilt worden. Diese Reaktionen wurden am häufigsten beobachtet, wenn das Vinca-Alkaloid in Kombination mit Mitomycin-C angewendet wurde, und können eine aggressive Behandlung erfordern, vor allem im Fall einer vorbestehenden Lungenfunktionsstörung. Diese Reaktionen können Minuten bis mehrere Stunden nach der Injektion des Vinca-Alkaloids einsetzen, auch dann, wenn das Vinca-Alkaloid bis zu 2 Wochen nach Mitomycin-C verabreicht wurde. Es kann zu einer progressiven Dyspnoe kommen, die eine chronische Behandlung erfordert. Das Vinca-Alkaloid sollte nicht wieder verabreicht werden.Vincristin-Teva kann die Fortpflanzungsfähigkeit beeinträchtigen. Bei männlichen Patienten wurde Aspermie beobachtet, die bei Anwendung der Kombination Vincristin-Teva/Procarbazin/alkylierendes Mittel/Prednison – wenn überhaupt – meist erst nach 2 Jahren therapiefreier Remission reversibel war. Die bei einigen Patientinnen unter der genannten Kombinationsbehandlung aufgetretene Amenorrhö war häufig reversibel.Wenn Injektionslösung in das paravenöse Gewebe gelangt, kann es zu Nekrosen kommen. Die Injektion ist in einem solchen Fall sofort abzubrechen. Um die in das paravenöse Gewebe eingedrungene Lösung schneller zu verteilen und damit die Beschwerden und das Risiko einer Gewebsreizung zu verringern, kann Hyaluronidase lokal injiziert und mässige Wärme auf die betroffene Stelle angewendet werden.Vincristin-Teva darf nicht intrathekal verabreicht werden, da dies zu lebensbedrohenden Lähmungen führt. Nach versehentlicher intrathekaler Gabe ist umgehend ein neurochirurgischer Eingriff erforderlich, um eine aufsteigende Lähmung mit Todesfolge zu verhindern (siehe «Sonstige Hinweise/Hinweise für die Handhabung»).InteraktionenBei gleichzeitiger oraler oder intravenöser Verabreichung von Phenytoin und antineoplastischen Chemotherapie-Kombinationen, welche Vincristin einschlossen, wurde über eine Senkung der Phenytoin-Blutspiegel und eine Erhöhung der Krampfaktivität berichtet. Die Interaktion beruht möglicherweise auf einer verminderten Resorption und/oder einer verstärkten Metabolisierung und Elimination von Phenytoin. Bei der Anwendung in Kombination mit Vincristin kann eine Anpassung der Phenytoin-Dosierung auf der Basis regelmässiger Blutspiegelkontrollen notwendig sein.Da Vincristin über CYP3A4 metabolisiert wird, ist Vorsicht geboten bei gleichzeitiger Behandlung mit Inhibitoren (z.B. Ketoconazol, Itraconazol, Erythromycin), Induktoren (z.B. Hypericum-Präparate) oder Substraten von CYP3A4.Wenn Vincristin in Kombination mit L-Asparaginase angewendet wird, sollte Vincristin 12–24 Stunden vor der Verabreichung der L-Asparaginase gegeben werden, um die Toxizität zu minimieren. Verabreichung von L-Asparaginase vor Vincristin kann die hepatische Clearance von Vincristin reduzieren.Schwangerschaft/StillzeitVinca-Alkaloide dürfen während der Schwangerschaft nicht angewendet werden, da diese im Tierversuch teratogene und embryoletale Wirkungen zeigen. Frauen im gebärfähigen Alter müssen vor Beginn und während der Behandlung mit Vincristin-Teva eine sichere Kontrazeption durchführen. Tritt während der Behandlung mit Vincristin-Teva dennoch eine Schwangerschaft ein, so ist die Möglichkeit einer genetischen Beratung zu nutzen. Vincristin ist genotoxisch, daher wird auch bei Kinderwunsch nach einer Therapie eine genetische Beratung empfohlen.Es ist nicht bekannt, ob Vincristin in die Muttermilch übergeht. Daher soll Vincristin-Teva während der Stillzeit nicht verabreicht werden oder es soll abgestillt werden.Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDie Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen wurde nicht untersucht.Unerwünschte WirkungenDie unerwünschten Wirkungen sind im Allgemeinen reversibel und dosisabhängig. Am häufigsten wird Alopezie beobachtet, am unangenehmsten sind die neuromuskulären Störungen.Bei Einhaltung des empfohlenen Dosierungsschemas von einer Dosis pro Woche sind im Allgemeinen Nebenwirkungen wie Leukopenie, neuritische Schmerzen, Obstipation und Gehbehinderung nur kurzdauernd (weniger als 7–10 Tage).Manche Erscheinungen, wie Haarausfall, Parästhesien, schleppender Gang, Verlust der tiefen Sehnenreflexe und Muskelschwund, bleiben häufig während der Behandlungszeit bestehen und verschwinden im Allgemeinen innerhalb 6 Wochen nach Beendigung der Therapie. Bei einigen Patienten sind die neuromuskulären Beschwerden für längere Zeit bestehen geblieben.Blut und LymphsystemSelten: Leukopenie. Vincristin hat gewöhnlich keinen wesentlichen Einfluss auf Erythrozyten und Thrombozyten.ImmunsystemEs wurde über seltene Fälle von allergischen Reaktionen wie Anaphylaxie, Hautausschlag und Ödeme berichtet, welche in zeitlichem Zusammenhang mit einer Vincristin-Behandlung und der Gabe von anderen Chemotherapeutika auftraten.Endokrine StörungenSehr seltene Störung der Sekretion des antidiuretischen Hormons mit erhöhter Natriumausscheidung und erniedrigten Blutnatriumwerten. Es bestehen dabei keine Erkrankung der Nebennieren oder der Nieren, kein erniedrigter Blutdruck, keine Dehydrierung oder Azotämie und keine klinisch manifesten Ödeme. Einschränkung der Flüssigkeitsaufnahme bessert die Hyponatriämie und den renalen Natriumverlust.Stoffwechsel- und ErnährungsstörungenGewichtsverlust.NervensystemDie unerwünschten neuromuskulären Wirkungen treten häufig in einer bestimmten Reihenfolge auf. Zunächst kommt es zu Sensibilitätsstörungen und Parästhesien. Bei Fortsetzung der Behandlung können dann auch neuritisartige Schmerzen und später motorische Ausfälle auftreten. Eine spezifische Behandlung dieser Beschwerden ist bis jetzt nicht bekannt.Bei einigen Patienten wurden Krämpfe, häufig verbunden mit Hochdruck verzeichnet. Bei Kindern traten in einigen Fällen komatöse Zustände auf. Ferner wurden Verlust der tiefen Sehnenreflexe, Ataxie, Spitzfuss, Parästhesien und Taubheit der Finger- und Zehenspitzen beobachtet.Vorbestehende neurologische Beschwerden werden durch die Gabe von Vincristin-Teva oft verschlechtert.Hirnnervenlähmungen (extraokuläre, laryngeale Muskulatur) können auch ohne motorische Ausfälle anderer Lokalisation auftreten. Schwere Schmerzen im Bereich der Mundhöhle, des Pharynx und der Glandula parotis wurden berichtet.Kopfschmerz.AugenleidenAtrophie des N. opticus mit Blindheit und vorübergehender kortikaler Blindheit.Ohr und InnenohrÜber das Auftreten von teilweiser und vollständiger Taubheit vorübergehender oder permanenter Natur wurde berichtet.Herz und GefässeHyper- und Hypotension sind vorgekommen. Chemotherapie-Kombinationen mit Vincristin-Teva waren (vor allem bei Patienten mit vorheriger mediastinaler Bestrahlung) mit koronarer Herzkrankheit und Myokardinfarkt assoziiert. Ein kausaler Zusammenhang wurde nicht nachgewiesen.AtmungsorganeEs wurde über schweren Bronchospasmus und über akute Atemnot nach der Verabreichung von Vinca-Alkaloiden berichtet. Diese Reaktionen wurden zumeist bei einer Kombinationsbehandlung mit Mitomycin-C beobachtet, besonders bei vorbestehender Lungenfunktionsstörung (siehe «Warnhinweise und Vorsichtsmassnahmen»).Gastrointestinale StörungenStomatitis. Obstipation und kolikartige Bauchschmerzen, die auf einer Verstopfung im oberen Kolon beruhen, können auftreten. Es können aber auch kolikartige Schmerzen bei leerem Rektum vorliegen. Die Obstipationen sprechen auf hohe Einlaufe und Abführmittel an. Eine routinemässige Obstipationsprophylaxe von Beginn der Behandlung an wird empfohlen.Vor allem bei kleinen Kindern und älteren Menschen kann es zu einem paralytischen Ileus kommen. Der Ileus, der ein akutes Abdomen vortäuschen kann, bildet sich zurück, wenn Vincristin-Teva vorübergehend abgesetzt und eine symptomatische Behandlung angewendet wird.Über abdominelle Krämpfe, Erbrechen und Durchfälle, sowie über Perforationen wurde berichtet. Zur Absicherung der Diagnose ist eine Röntgenaufnahme des Abdomens zweckmässig.Leber und GalleIn seltenen Fällen ist bei Patienten, welche Vincristin als Teil einer Kombinationschemotherapie erhielten, eine Lebervenenverschlusskrankheit mitgeteilt worden. Bei alleiniger Anwendung dieses Wirkstoffs war jedoch kein Zusammenhang mit Vincristin nachweisbar.HautHaarausfall, Dermatitis.MuskelskelettsystemKiefer-, Knochen-, Rücken-, Gliederschmerzen und Myalgien wurden berichtet.Nieren und HarnwegePolyurie, Dysurie und Harnverhalten durch Blasenatonie sind vorgekommen. Unter Vincristin kann gelegentlich eine akute Harnsäurenephropathie auftreten. Folgende vorbeugende Massnahmen sind daher zu empfehlen:Ausreichende Flüssigkeitszufuhr, Alkalisierung des Urins, Kontrolle des Harnsäurespiegels, Verabreichung von Allopurinol.Allgemeine Störungen und Reaktionen an der ApplikationsstelleFieber. Nekrosen bei versehentlicher paravenöser Gabe.ÜberdosierungDie nach Anwendung von Vincristin-Teva auftretenden Nebenwirkungen sind dosisabhängig. Deshalb ist zu erwarten, dass bei einer Überschreitung der empfohlenen Dosis die Nebenwirkungen besonders stark in Erscheinung treten.Da Vincristin-Teva kaum dialysierbar ist, ist eine Hämodialyse bei Überdosierung nicht angezeigt.Im Falle einer Überdosierung sind folgende Massnahmen zu erwägen:Verhütung der Nebenwirkungen, die von einer Störung in der Sekretion des antidiuretischen Hormons herrühren. Dies heisst u.a.: Einschränkung der Flüssigkeitsaufnahme und eventuell die Anwendung eines auf die Henle-Schleife und die Funktion des distalen Tubulus wirkenden Diuretikums;Verabreichung eines Antikonvulsivums;Anwendung von Abführmitteln, um einem Ileus vorzubeugen;Überwachung des Herz-Kreislaufsystems;Tägliches Blutbild, um den Transfusionsbedarf zu erkennen und das Infektionsrisiko abzuschätzen.Da man Labortiere mit Folinsäure vor letalen Vincristin-Dosen schützen kann, erscheint es sinnvoll, Patienten, die eine Überdosis von Vincristin-Teva erhalten haben, ebenfalls mit Folinsäure zu behandeln.Dosierungsvorschlag: 50–100 mg Folinsäure i.v. alle 3 Stunden über 48 Stunden, dann alle 6 Stunden mindestens über weitere 48 Stunden.Nach theoretischer Berechnung aus pharmakokinetischen Daten müssten die Gewebespiegel von Vincristin mindestens 72 Stunden lang wesentlich erhöht bleiben.Eine Behandlung mit Folinsäure entbindet nicht von der Notwendigkeit, die oben genannten, unterstützenden Massnahmen zu ergreifen.Eigenschaften/WirkungenATC-Code: L01CA02Vincristin gehört zu den Vinca-Alkaloiden und ist ein onkolytischer Wirkstoff. Der Wirkungsmechanismus von Vincristin wird durch die Hemmung der Mikrotubuli-Bildung in der Mitosespindel erklärt, die zu einem Stillstand der Zellteilung im Metaphasestadium führt.PharmakokinetikDie Pharmakokinetik von Vincristin ist triphasisch.DistributionDas Verteilungsvolumen von Vincristin beträgt 262 l/m². Zur Plasmaproteinbindung liegen keine Angaben vor.Die Penetration in die Zerebrospinalflüssigkeit scheint gering zu sein.MetabolismusVincristin-Teva wird grösstenteils in der Leber metabolisiert. Am Metabolismus ist CYP3A4 beteiligt.EliminationDie terminale Halbwertszeit von Vincristin beträgt 85 Stunden (Bereich 19–155 Stunden). Die Elimination erfolgt zu etwa 80% mit den Faeces und zu 10–20% mit dem Urin.Kinetik spezieller PatientengruppenZur Pharmakokinetik bei älteren Patienten, Kindern und Jugendlichen sowie Patienten mit Leber- und Niereninsuffizienz liegen keine Daten vor.Präklinische DatenUntersuchungen zu Vinca-Alkaloiden haben in akuten und chronischen Tierversuchen dosisabhängige Mylotoxizität gezeigt. Gleichzeitig kann eine Atrophie der Lymph- und Milzfollikel auftreten. Bei hohen Dosierungen kann ein Anstieg der Leberenzyme als Anzeichen einer Hepatotoxizität gewertet werden.Zur kardiovaskulären Verträglichkeit der Vinca-Alkaloide sind aus der Literatur mit niedriger Inzidenz Ereignisse wie Angina pectoris und Myokardinfarkt bekannt.Die Interaktion von Vincristin mit dem Spindelapparat während der Zellteilung kann zu einer Fehlverteilung der Chromosomen führen, und die Substanz kann deshalb mutagene Effekte erzeugen. Es ist davon auszugehen, dass Vincristin auch beim Menschen mutagene Wirkungen auslösen kann. Karzinogenitätsstudien liegen keine vor.Vinca-Alkaloide haben sich im Tierversuch teratogen und embryotoxisch gezeigt.Sonstige HinweiseInkompatibilitätenVincristin-Teva darf nur mit den unter «Hinweise für die Handhabung» aufgeführten Arzneimitteln gemischt werden.HaltbarkeitVincristin-Teva darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.Die Vincristin-Teva Injektionslösung ist nicht konserviert. Daher sind allfällige Reste nach Anbruch der Durchstechflasche zu verwerfen.Die in 0,9% NaCl oder 5% Glukose verdünnte Vincristin-Lösung ist in einer Konzentration von 0,01–0,1 mg/ml während 48 Std. im Kühlschrank (2–8 °C) oder während 24 Std. bei Raumtemperatur (15–25 °C) chemisch und physikalisch stabil.Aus mikrobiologischer Sicht sollte die Lösung aber sofort nach dem Verdünnen verwendet werden. Falls sie nicht sofort gebraucht wird, liegen die Aufbewahrungsdauer und die Aufbewahrungsbedingungen in der Verantwortung des Anwenders und sollten nicht länger als 24 Std. bei 2–8 °C betragen ausser die Verdünnung erfolgte unter kontrollierten und validierten aseptischen Bedingungen.Besondere LagerungshinweiseVincristin-Teva muss im Kühlschrank (2–8 °C) und vor Licht geschützt in der Originalpackung aufbewahrt werden.Hinweise für die HandhabungZytostatika-HinweisBei der Handhabung, Verabreichung und Entsorgung der Injektionslösung sind die Vorschriften für Zytostatika zu befolgen.Verabreichung der InjektionslösungVincristin-Teva muss streng intravenös verabreicht werden; Paravasate können zu Nekrosen führen (siehe «Warnhinweise und Vorsichtsmassnahmen»).Die Injektion erfolgt entweder direkt intravenös oder in den Schlauch einer laufenden intravenösen Infusion (Natriumchlorid 0,9% oder Glucose 5%) und sollte in etwa einer Minute abgeschlossen sein.Vincristin-Teva darf nicht intrathekal verabreicht werden, da dies zu lebensbedrohlichen Lähmungen führt. Nach versehentlicher intrathekaler Gabe ist umgehend ein neurochirurgischer Eingriff erforderlich, um eine aufsteigende Lähmung mit Todesfolge zu verhindern.Bei einer sehr kleinen Anzahl Patienten wurden eine lebensbedrohliche Lähmung und anschliessender Tod verhindert. Es kam allerdings zu schwerwiegenden neurologischen Folgeerscheinungen und nur begrenzter späterer Erholung.Aufgrund der veröffentlichten Behandlung dieser überlebenden Fälle sollte nach einer versehentlichen intrathekalen Gabe von Vincristin-Teva sofort mit der folgenden Behandlung begonnen werden:1.Über einen lumbalen Zugang soviel Rückenmarksflüssigkeit wie risikolos möglich entfernen.2.Einbringen eines Epiduralketheters in den Subarachnoidalraum über den Intervertebralraum oberhalb des initialen lumbalen Zugangs und Spülung der Cerebrospinalflüssigkeit mit Ringer-Laktat-Lösung. Frischplasma (Fresh frozen plasma) sollte angefordert werden. Sobald es zur Verfügung steht, sollte die Ringer-Laktat-Lösung mit 25 ml Frischplasma (Fresh frozen plasma) pro Liter versetzt werden.3.Einbringen eines intraventrikulären Drains oder Katheters durch einen Neurochirurgen und Fortsetzung der Spülung der Cerebrospinalflüssigkeit, wobei Flüssigkeit durch den lumbalen Zugang entfernt wird, der mit einem geschlossenen Drainage-System verbunden ist. Ringer-Laktat-Lösung wird kontinuierlich infundiert, 150 ml/Stunde bzw. 75 ml/Stunde, nachdem Frischplasma hinzugefügt wurde.Die Geschwindigkeit der Infusion sollte so angepasst werden, dass die Protein-Konzentration in der Cerebrospinalflüssigkeit 150 mg/dl beträgt.Folgende Massnahmen wurden zusätzlich angewandt, ohne dass ihr Nutzen unmittelbar bewiesen ist:Eine Infusion von 10 g Glutaminsäure über 24 Stunden, gefolgt von einer täglichen oralen Gabe von 3× 500 mg Glutaminsäure für die Dauer von 1 Monat.100 mg Folinsäure als Bolus-Injektion, gefolgt von einer 24stündigen Infusion von 25 mg Folinsäure/Stunde, anschliessend 4× 25 mg Folinsäure i.v./Tag für eine Woche.50 mg Pyridoxin wurden alle 8 Stunden über 30 Minuten intravenös infundiert.Welche Rolle diese Substanzen bei der Verminderung der Neurotoxizität spielten, ist unklar.Zulassungsnummer48000 (Swissmedic).ZulassungsinhaberinTeva Pharma AG, Basel.用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 长春新碱注射剂(Vincristin Injektionslösung)
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 长春新碱注射剂(Vincristin Injektionslösung)