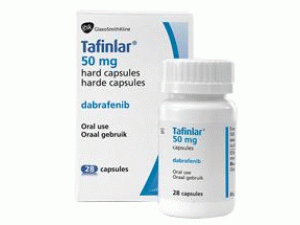
达拉非尼胶囊dabrafenib(Tafinlar 50mg Capsules)
 产地国家:法国
处方药:是
所属类别: 50毫克/胶囊 28胶囊/瓶
包装规格: 50毫克/胶囊 28胶囊/瓶
计价单位:瓶
生产厂家英文名:GlaxoSmithKline
原产地英文商品名:Tafinlar 50mg/Capsules 28/Capsules/box
原产地英文药品名:dabrafenib
中文参考商品译名:Tafinlar 50毫克/胶囊 28胶囊/瓶
中文参考药品译名:甲磺酸达拉菲尼
产地国家:法国
处方药:是
所属类别: 50毫克/胶囊 28胶囊/瓶
包装规格: 50毫克/胶囊 28胶囊/瓶
计价单位:瓶
生产厂家英文名:GlaxoSmithKline
原产地英文商品名:Tafinlar 50mg/Capsules 28/Capsules/box
原产地英文药品名:dabrafenib
中文参考商品译名:Tafinlar 50毫克/胶囊 28胶囊/瓶
中文参考药品译名:甲磺酸达拉菲尼
简介:
Tafinlar(dabrafenib)突破性疗法认定,用于既往接受过至少一次含铂化疗方案的BRAF V600E突变阳性转移性非小细胞肺癌(NSCLC)患者的治疗。目前,dabrafenib还未获批用于该种疾病环境。这是GSK获得的第四个突破性疗法认定。Dabrafenib突破性疗法认定的授予,是基于一项正在开展的II期研究的中期疗效和安全性数据。该项研究在25例携带BRAF V600E突变、且既往接受过至少一次含铂化疗方案的NSCLC患者中开展,研究中将dabrafenib进行口服给药。这些中期数据已提交至2013年美国临床肿瘤学会年会。肺癌是男性和女性中的第二大常见癌症,是目前癌症相关死亡的主要原因之一。肿瘤生物学中的最新进展已确定了肺癌相关的基因突变,如BRAF蛋白中的突变,这些突变能够驱动非小细胞肺癌(NSCLC)中恶性细胞的生长和肿瘤的增殖。据估计,dabrafenib靶向的BRAF V600E突变,约占NSCLC病例的2.0%。关于Tafinlar(dabrafenib):Tafinlar是葛兰素史克开发的一种抗癌药物,该药已分别于2013年5月和9月获FDA和EMA批准,用于携带BRAF V600E突变的手术不可切除性黑色素瘤或转移性黑色素瘤成人患者的治疗。dabrafenib为一种激酶抑制剂,靶向于BRAF蛋白,这是机体内一个生物信号通路中的关键元件,该信号通路调节细胞的正常生长和死亡,包括皮肤细胞。转移性黑色素瘤中,约有一半携带BRAF突变,该异常突变能促使黑色素瘤生长和扩散。TAFINLAR(达拉非尼[dabrafenib])胶囊,为口服使用美国初始批准:2013最近主要修改(红色仿宋为修改部分,下文相同)适应证和用途 (1.2) 01/2014剂量和给药方法(2.1-2.3) 01/2014警告和注意事项(5-5.9, 11) 01/2014 适应症:TAFINLAR是一种激酶抑制剂。(1)于治疗患有BRAF V600E突变的不可切除或转移性黑色素瘤患者,如FDA批准的检测。(2)AFINLAR与trametinib联合用于:通过FDA批准的测试检测BRAF V600E或V600K突变对不可切除或转移性黑色素瘤患者的治疗。(3)过FDA批准的测试检测到的BRAF V600E或V600K突变的黑色素瘤患者的辅助治疗,以及完全切除后淋巴结的参与。(4)过FDA批准的试验检测BRAF V600E突变的转移性非小细胞肺癌(NSCLC)患者的治疗。(5)BRAF V600E突变治疗局部晚期或转移性间变性甲状腺癌(ATC)并且没有令人满意的局部治疗选择的患者。 使用限制:TAFINLAR不适用于野生型BRAF黑色素瘤,野生型BRAF NSCLC或野生型BRAF ATC患者的治疗。 剂量和给药:推荐剂量的TAFINLAR每日口服150毫克。至少在餐前1小时或餐后至少2小时服用TAFINLAR。 剂量形式和强度:胶囊,50mg,75mg 禁忌症:没有 警告和注意事项: 新的原发性恶性肿瘤,皮肤和非皮肤:当TAFINLAR作为单一药物或与trametinib一起给药时可能发生。在治疗前或治疗期间以及停止治疗后监测患者的新恶性肿瘤。 BRAF野生型肿瘤中的肿瘤促进:BRAF抑制剂可以增加细胞增殖。 出血:接受TAFINLAR和trametinib的患者可能发生严重的出血事件。监测出血的体征和症状。 心肌病:在治疗一个月后用TAFINLAR和trametinib治疗前评估LVEF,之后每2至3个月评估一次。 葡萄膜炎:对任何视力障碍进行眼科评估。 严重的发热反应:TAFINLAR和trametinib可增加发热的发病率和严重程度。 严重皮肤毒性:监测皮肤毒性。尽管TAFINLAR中断,但在3周内无法忍受无法忍受的2级或3级或4级皮疹仍未改善。 高血糖:监测患有糖尿病或高血糖的患者的血糖水平。 葡萄糖-6-磷酸脱氢酶缺乏症:密切监测溶血性贫血。 与联合治疗相关的风险:查看trametinib的完整处方信息,了解在开始使用TAFINLAR和trametinib之前trametinib的严重风险。 胚胎 - 胎儿毒性:可导致胎儿伤害。告知女性对胎儿有潜在风险的生殖潜力,并使用有效的非激素避孕方法。 不良反应:TAFINLAR作为单一药物的最常见不良反应(≥20%)是角化过度,头痛,发热,关节痛,乳头状瘤,脱发和手掌-足底红斑感觉综合征。TAFINLAR与托美替尼联合应用的最常见不良反应(≥20%)包括:不可切除或转移性黑色素瘤:发热,皮疹,发冷,头痛,关节痛和咳嗽。黑色素瘤的辅助治疗:发热,疲劳,恶心,头痛,皮疹,畏寒,腹泻,呕吐,关节痛和肌痛。NSCLC:发热,乏力,恶心,呕吐,腹泻,皮肤干燥,食欲减退,水肿,皮疹,畏寒,出血,咳嗽和呼吸困难。 药物相互作用:避免同时使用CYP3A4或CYP2C8的强抑制剂。与作为CYP3A4,CYP2C8,CYP2C9,CYP2C19或CYP2B6的敏感底物的试剂同时使用可能导致这些试剂的功效丧失。 用于特定人群:哺乳期,不要母乳喂养。女性和生殖潜力的雄性:可能会影响生育能力。 包装:50毫克胶囊,75毫克胶囊 储存:在25°C(77°F);允许偏移15ºC至30°C(59ºF至86°F)[见USP受控室温]。用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 达拉非尼胶囊dabrafenib(Tafinlar 50mg Capsules)
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 达拉非尼胶囊dabrafenib(Tafinlar 50mg Capsules)