凝血因子VIIa[重组]-jncw_ Sevenfact_凝血因子VIIa[重组]-jncw 冻干粉注射剂recombinant说明书
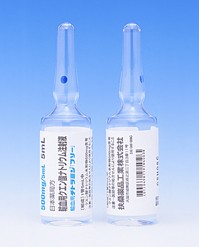
[caption id="attachment_34837" align="alignleft" width="300"] Sevenfact 1mg vial(凝血因子VIIa[重组]-jncw 冻干粉注射剂)[/caption]药店国别:
产地国家:美国
处 方 药:是
所属类别:1毫克/瓶
包装规格:1毫克/瓶
计价单位:瓶
生产厂家中文参考译名:HEMA Biologics
生产厂家英文名:HEMA Biologics
原产地英文商品名:Sevenfact Powder Injection 1mg/vial
原产地英文药品名:coagulation factor VIIa(recombinant)-jncw
中文参考商品译名:Sevenfact冻干粉注射剂 1毫克/瓶
中文参考药品译名:凝血因子VIIa(重组)-jncw
简介:
近日,美国食品药品监督管理局(FDA)批准Sevenfact(coagulation factor VIIa[recombinant]-jncw])冻干粉注射剂,用于治疗和控制12岁及以上患有A型或B型血友病的成人和青少年的出血事件抑制剂(中和抗体)。Sevenfact包含在转基因兔子中表达的活性成分。
FDA生物学评估和研究中心主任Peter Marks博士说:“今天的批准为控制已开发出抑制剂的血友病成人和青少年的出血发作提供了另一种治疗选择。” “除了是患者的重要选择之外,Sevenfact还是血友病治疗的首款产品,其中包含从转基因兔子体内获得的活性成分,这些兔子经过基因工程改造后可产生凝血所需的蛋白质。这项批准是我们努力推动安全生物技术创新以支持患者健康的一个例子。”
血友病A或B是分别由凝血因子(F)VIII或IX的功能障碍或缺乏引起的先天性出血性疾病。血友病患者受伤或手术后流血的时间可能比其他人更长。它们还可能在肌肉,关节和器官中自发性出血,可能会危及生命。具有抑制剂的个体可能对因子替代疗法无反应。根据疾病控制与预防中心(CDC)的数据,在美国,估计有20,000人患有血友病。这些患者的出血发作可通过按需治疗或使用含FVIII或FIX的产品进行预防来控制。但是,当这些个体中出现FVIII或FIX抑制剂时,用FVIII或FIX产物治疗出血发作可能不再有效。
批准日期:2020年4月1日 公司:HEMA Biologics
SEVENFACT(凝血因子VIIa[coagulation factor VIIa[recombinant]-jncw])注射,静脉用溶液冻干粉
最初的美国批准时间:2020年
警告:血栓形成
有关完整的框内警告,请参阅完整的处方信息。
•服用SEVENFACT后可能发生严重的动脉和静脉血栓形成事件。
•与接受SEVENFACT®的患者讨论风险并解释血栓形成和血栓栓塞事件的体征和症状。
•监视患者凝血系统激活的体征或症状以及血栓形成情况。
作用机理:
SEVENFACT中的活性成分是人因子VIIa(维生素K依赖性凝血因子)的重组类似物。在钙和磷脂的存在下,与组织因子(TF)形成复合物的因子VIIa将因子X活化为因子Xa,直接绕过需要因子VIII或因子IX的反应。 因子X向因子Xa的活化启动了凝血级联反应的常见途径,在该途径中,凝血酶原被激活为凝血酶,然后凝血酶将纤维蛋白原转化为纤维蛋白以形成止血栓,从而在出血部位(止血)形成凝块。在活化血小板表面上不存在TF的情况下,也可能发生此过程。
适应症和用途:
SEVENFACT [凝血因子VIIa(重组)-jncw]是一种凝血因子VIIa浓缩物,适用于治疗和控制A或B血友病伴抑制剂的成人和青少年(12岁及以上)发生的出血事件。
使用限制:SEVENFACT不适合治疗先天性因子VII缺乏症。
用法用量:
仅在重构后用于静脉使用。
先天性血友病A或B伴有抑制剂的出血事件。
出血类型 剂量方案建议
每3小时重复75微克/公斤,直到止血为止
对于轻度或中度出血:或
初始剂量为225微克/公斤。如果在9小时
内未达到止血效果,则可根据需要每
3小时额外服用75微克/公斤剂量。
出血类型 剂量方案建议
对于严重出血: 225微克/公斤,如果需要的话,随后进行
6个小时,之后每2个小时75微克/公斤。
剂量形式和强度:
SEVENFACT可以在含有1或5mg凝血因子VIIa(重组)-jncw的单次使用小瓶中制成冻干粉。之后用指定体积的无菌注射用水配制,每毫升包含1mg(1000mcg)或凝血因子VIIa(重组)-jncw。
禁忌症:
已知对兔子或兔子蛋白过敏。对SEVENFACT或其任何成分的严重超敏反应。
警告和注意事项:
•患有血友病A或B且具有其他血栓形成危险因素的抑制剂的患者,发生严重动脉和静脉血栓形成事件的风险可能会增加。
•SEVENFACT可能会引起过敏反应,包括过敏反应。如果出现症状,患者应中止SEVENFACT并寻求适当的医学干预。
不良反应:
SEVENFACT临床试验中报告的最常见不良反应(发生率≥1%)为头痛,头晕,输液部位不适,输液部位血肿,输液相关反应和发烧。
药物相互作用:
与活化的凝血酶原复合物浓缩物同时使用时,含有FVIIa的产品在药理上的临床使用经验表明发生严重血栓事件的风险升高。
包装供应/存储和处理方式:
供应方式:
•SEVENFACT [凝血因子VIIa(重组)-jncw],以室温稳定的白色至灰白色冻干粉末形式提供,在一次性使用的小瓶中,每小瓶装一瓶。SEVENFACT的稀释剂是注射用水,以无色透明溶液的形式在预填充注射器中提供。
规格 :
每瓶1毫克 黄色 71127-1000-1 •1个1毫克SEVENFACT单药
剂量[NDC 71127-1100-1]
•1个装有1.1mL无菌注射
用水的预填充注射器
[NDC 71127-1200-1]
•1个13mm的样品瓶适
配器,带5微米过滤器
每瓶5毫克 紫色 NDC 71127-5000-1 •1个5毫克的SEVENFACT单
药合用药[NDC 71127-5100-1]
•1个装有5.2mL无菌注射用水
的预填充注射器[NDC 71127-5200-1]
•1个带有5微米过滤器的20mm样品瓶适配器
•SEVENFACT样品瓶由玻璃制成,用溴丁基橡胶塞(不是用天然橡胶乳胶制成)封闭,并用铝盖密封。
•预填充的稀释剂注射器由玻璃制成,带有硅化的溴化丁基橡胶柱塞(非天然橡胶胶乳制成)。
储存和处理:
•复溶之前,SEVENFACT试剂盒应在室温下保存,但应保存在36°F至86°F(2°C至30°C)之间,并应避开产品包装中的光线。不要冻结。
•复溶后,SEVENFACT应在室温下保存,但可以在36°F至86°F(2°C至30°C)之间存储长达4小时。 不要冷冻或存放在注射器中。
Sevenfact 1mg vial(凝血因子VIIa[重组]-jncw 冻干粉注射剂)[/caption]药店国别:
产地国家:美国
处 方 药:是
所属类别:1毫克/瓶
包装规格:1毫克/瓶
计价单位:瓶
生产厂家中文参考译名:HEMA Biologics
生产厂家英文名:HEMA Biologics
原产地英文商品名:Sevenfact Powder Injection 1mg/vial
原产地英文药品名:coagulation factor VIIa(recombinant)-jncw
中文参考商品译名:Sevenfact冻干粉注射剂 1毫克/瓶
中文参考药品译名:凝血因子VIIa(重组)-jncw
简介:
近日,美国食品药品监督管理局(FDA)批准Sevenfact(coagulation factor VIIa[recombinant]-jncw])冻干粉注射剂,用于治疗和控制12岁及以上患有A型或B型血友病的成人和青少年的出血事件抑制剂(中和抗体)。Sevenfact包含在转基因兔子中表达的活性成分。
FDA生物学评估和研究中心主任Peter Marks博士说:“今天的批准为控制已开发出抑制剂的血友病成人和青少年的出血发作提供了另一种治疗选择。” “除了是患者的重要选择之外,Sevenfact还是血友病治疗的首款产品,其中包含从转基因兔子体内获得的活性成分,这些兔子经过基因工程改造后可产生凝血所需的蛋白质。这项批准是我们努力推动安全生物技术创新以支持患者健康的一个例子。”
血友病A或B是分别由凝血因子(F)VIII或IX的功能障碍或缺乏引起的先天性出血性疾病。血友病患者受伤或手术后流血的时间可能比其他人更长。它们还可能在肌肉,关节和器官中自发性出血,可能会危及生命。具有抑制剂的个体可能对因子替代疗法无反应。根据疾病控制与预防中心(CDC)的数据,在美国,估计有20,000人患有血友病。这些患者的出血发作可通过按需治疗或使用含FVIII或FIX的产品进行预防来控制。但是,当这些个体中出现FVIII或FIX抑制剂时,用FVIII或FIX产物治疗出血发作可能不再有效。
批准日期:2020年4月1日 公司:HEMA Biologics
SEVENFACT(凝血因子VIIa[coagulation factor VIIa[recombinant]-jncw])注射,静脉用溶液冻干粉
最初的美国批准时间:2020年
警告:血栓形成
有关完整的框内警告,请参阅完整的处方信息。
•服用SEVENFACT后可能发生严重的动脉和静脉血栓形成事件。
•与接受SEVENFACT®的患者讨论风险并解释血栓形成和血栓栓塞事件的体征和症状。
•监视患者凝血系统激活的体征或症状以及血栓形成情况。
作用机理:
SEVENFACT中的活性成分是人因子VIIa(维生素K依赖性凝血因子)的重组类似物。在钙和磷脂的存在下,与组织因子(TF)形成复合物的因子VIIa将因子X活化为因子Xa,直接绕过需要因子VIII或因子IX的反应。 因子X向因子Xa的活化启动了凝血级联反应的常见途径,在该途径中,凝血酶原被激活为凝血酶,然后凝血酶将纤维蛋白原转化为纤维蛋白以形成止血栓,从而在出血部位(止血)形成凝块。在活化血小板表面上不存在TF的情况下,也可能发生此过程。
适应症和用途:
SEVENFACT [凝血因子VIIa(重组)-jncw]是一种凝血因子VIIa浓缩物,适用于治疗和控制A或B血友病伴抑制剂的成人和青少年(12岁及以上)发生的出血事件。
使用限制:SEVENFACT不适合治疗先天性因子VII缺乏症。
用法用量:
仅在重构后用于静脉使用。
先天性血友病A或B伴有抑制剂的出血事件。
出血类型 剂量方案建议
每3小时重复75微克/公斤,直到止血为止
对于轻度或中度出血:或
初始剂量为225微克/公斤。如果在9小时
内未达到止血效果,则可根据需要每
3小时额外服用75微克/公斤剂量。
出血类型 剂量方案建议
对于严重出血: 225微克/公斤,如果需要的话,随后进行
6个小时,之后每2个小时75微克/公斤。
剂量形式和强度:
SEVENFACT可以在含有1或5mg凝血因子VIIa(重组)-jncw的单次使用小瓶中制成冻干粉。之后用指定体积的无菌注射用水配制,每毫升包含1mg(1000mcg)或凝血因子VIIa(重组)-jncw。
禁忌症:
已知对兔子或兔子蛋白过敏。对SEVENFACT或其任何成分的严重超敏反应。
警告和注意事项:
•患有血友病A或B且具有其他血栓形成危险因素的抑制剂的患者,发生严重动脉和静脉血栓形成事件的风险可能会增加。
•SEVENFACT可能会引起过敏反应,包括过敏反应。如果出现症状,患者应中止SEVENFACT并寻求适当的医学干预。
不良反应:
SEVENFACT临床试验中报告的最常见不良反应(发生率≥1%)为头痛,头晕,输液部位不适,输液部位血肿,输液相关反应和发烧。
药物相互作用:
与活化的凝血酶原复合物浓缩物同时使用时,含有FVIIa的产品在药理上的临床使用经验表明发生严重血栓事件的风险升高。
包装供应/存储和处理方式:
供应方式:
•SEVENFACT [凝血因子VIIa(重组)-jncw],以室温稳定的白色至灰白色冻干粉末形式提供,在一次性使用的小瓶中,每小瓶装一瓶。SEVENFACT的稀释剂是注射用水,以无色透明溶液的形式在预填充注射器中提供。
规格 :
每瓶1毫克 黄色 71127-1000-1 •1个1毫克SEVENFACT单药
剂量[NDC 71127-1100-1]
•1个装有1.1mL无菌注射
用水的预填充注射器
[NDC 71127-1200-1]
•1个13mm的样品瓶适
配器,带5微米过滤器
每瓶5毫克 紫色 NDC 71127-5000-1 •1个5毫克的SEVENFACT单
药合用药[NDC 71127-5100-1]
•1个装有5.2mL无菌注射用水
的预填充注射器[NDC 71127-5200-1]
•1个带有5微米过滤器的20mm样品瓶适配器
•SEVENFACT样品瓶由玻璃制成,用溴丁基橡胶塞(不是用天然橡胶乳胶制成)封闭,并用铝盖密封。
•预填充的稀释剂注射器由玻璃制成,带有硅化的溴化丁基橡胶柱塞(非天然橡胶胶乳制成)。
储存和处理:
•复溶之前,SEVENFACT试剂盒应在室温下保存,但应保存在36°F至86°F(2°C至30°C)之间,并应避开产品包装中的光线。不要冻结。
•复溶后,SEVENFACT应在室温下保存,但可以在36°F至86°F(2°C至30°C)之间存储长达4小时。 不要冷冻或存放在注射器中。
 Sevenfact 1mg vial(凝血因子VIIa[重组]-jncw 冻干粉注射剂)[/caption]药店国别:
产地国家:美国
处 方 药:是
所属类别:1毫克/瓶
包装规格:1毫克/瓶
计价单位:瓶
生产厂家中文参考译名:HEMA Biologics
生产厂家英文名:HEMA Biologics
原产地英文商品名:Sevenfact Powder Injection 1mg/vial
原产地英文药品名:coagulation factor VIIa(recombinant)-jncw
中文参考商品译名:Sevenfact冻干粉注射剂 1毫克/瓶
中文参考药品译名:凝血因子VIIa(重组)-jncw
简介:
近日,美国食品药品监督管理局(FDA)批准Sevenfact(coagulation factor VIIa[recombinant]-jncw])冻干粉注射剂,用于治疗和控制12岁及以上患有A型或B型血友病的成人和青少年的出血事件抑制剂(中和抗体)。Sevenfact包含在转基因兔子中表达的活性成分。
FDA生物学评估和研究中心主任Peter Marks博士说:“今天的批准为控制已开发出抑制剂的血友病成人和青少年的出血发作提供了另一种治疗选择。” “除了是患者的重要选择之外,Sevenfact还是血友病治疗的首款产品,其中包含从转基因兔子体内获得的活性成分,这些兔子经过基因工程改造后可产生凝血所需的蛋白质。这项批准是我们努力推动安全生物技术创新以支持患者健康的一个例子。”
血友病A或B是分别由凝血因子(F)VIII或IX的功能障碍或缺乏引起的先天性出血性疾病。血友病患者受伤或手术后流血的时间可能比其他人更长。它们还可能在肌肉,关节和器官中自发性出血,可能会危及生命。具有抑制剂的个体可能对因子替代疗法无反应。根据疾病控制与预防中心(CDC)的数据,在美国,估计有20,000人患有血友病。这些患者的出血发作可通过按需治疗或使用含FVIII或FIX的产品进行预防来控制。但是,当这些个体中出现FVIII或FIX抑制剂时,用FVIII或FIX产物治疗出血发作可能不再有效。
批准日期:2020年4月1日 公司:HEMA Biologics
SEVENFACT(凝血因子VIIa[coagulation factor VIIa[recombinant]-jncw])注射,静脉用溶液冻干粉
最初的美国批准时间:2020年
警告:血栓形成
有关完整的框内警告,请参阅完整的处方信息。
•服用SEVENFACT后可能发生严重的动脉和静脉血栓形成事件。
•与接受SEVENFACT®的患者讨论风险并解释血栓形成和血栓栓塞事件的体征和症状。
•监视患者凝血系统激活的体征或症状以及血栓形成情况。
作用机理:
SEVENFACT中的活性成分是人因子VIIa(维生素K依赖性凝血因子)的重组类似物。在钙和磷脂的存在下,与组织因子(TF)形成复合物的因子VIIa将因子X活化为因子Xa,直接绕过需要因子VIII或因子IX的反应。 因子X向因子Xa的活化启动了凝血级联反应的常见途径,在该途径中,凝血酶原被激活为凝血酶,然后凝血酶将纤维蛋白原转化为纤维蛋白以形成止血栓,从而在出血部位(止血)形成凝块。在活化血小板表面上不存在TF的情况下,也可能发生此过程。
适应症和用途:
SEVENFACT [凝血因子VIIa(重组)-jncw]是一种凝血因子VIIa浓缩物,适用于治疗和控制A或B血友病伴抑制剂的成人和青少年(12岁及以上)发生的出血事件。
使用限制:SEVENFACT不适合治疗先天性因子VII缺乏症。
用法用量:
仅在重构后用于静脉使用。
先天性血友病A或B伴有抑制剂的出血事件。
出血类型 剂量方案建议
每3小时重复75微克/公斤,直到止血为止
对于轻度或中度出血:或
初始剂量为225微克/公斤。如果在9小时
内未达到止血效果,则可根据需要每
3小时额外服用75微克/公斤剂量。
出血类型 剂量方案建议
对于严重出血: 225微克/公斤,如果需要的话,随后进行
6个小时,之后每2个小时75微克/公斤。
剂量形式和强度:
SEVENFACT可以在含有1或5mg凝血因子VIIa(重组)-jncw的单次使用小瓶中制成冻干粉。之后用指定体积的无菌注射用水配制,每毫升包含1mg(1000mcg)或凝血因子VIIa(重组)-jncw。
禁忌症:
已知对兔子或兔子蛋白过敏。对SEVENFACT或其任何成分的严重超敏反应。
警告和注意事项:
•患有血友病A或B且具有其他血栓形成危险因素的抑制剂的患者,发生严重动脉和静脉血栓形成事件的风险可能会增加。
•SEVENFACT可能会引起过敏反应,包括过敏反应。如果出现症状,患者应中止SEVENFACT并寻求适当的医学干预。
不良反应:
SEVENFACT临床试验中报告的最常见不良反应(发生率≥1%)为头痛,头晕,输液部位不适,输液部位血肿,输液相关反应和发烧。
药物相互作用:
与活化的凝血酶原复合物浓缩物同时使用时,含有FVIIa的产品在药理上的临床使用经验表明发生严重血栓事件的风险升高。
包装供应/存储和处理方式:
供应方式:
•SEVENFACT [凝血因子VIIa(重组)-jncw],以室温稳定的白色至灰白色冻干粉末形式提供,在一次性使用的小瓶中,每小瓶装一瓶。SEVENFACT的稀释剂是注射用水,以无色透明溶液的形式在预填充注射器中提供。
规格 :
每瓶1毫克 黄色 71127-1000-1 •1个1毫克SEVENFACT单药
剂量[NDC 71127-1100-1]
•1个装有1.1mL无菌注射
用水的预填充注射器
[NDC 71127-1200-1]
•1个13mm的样品瓶适
配器,带5微米过滤器
每瓶5毫克 紫色 NDC 71127-5000-1 •1个5毫克的SEVENFACT单
药合用药[NDC 71127-5100-1]
•1个装有5.2mL无菌注射用水
的预填充注射器[NDC 71127-5200-1]
•1个带有5微米过滤器的20mm样品瓶适配器
•SEVENFACT样品瓶由玻璃制成,用溴丁基橡胶塞(不是用天然橡胶乳胶制成)封闭,并用铝盖密封。
•预填充的稀释剂注射器由玻璃制成,带有硅化的溴化丁基橡胶柱塞(非天然橡胶胶乳制成)。
储存和处理:
•复溶之前,SEVENFACT试剂盒应在室温下保存,但应保存在36°F至86°F(2°C至30°C)之间,并应避开产品包装中的光线。不要冻结。
•复溶后,SEVENFACT应在室温下保存,但可以在36°F至86°F(2°C至30°C)之间存储长达4小时。 不要冷冻或存放在注射器中。
Sevenfact 1mg vial(凝血因子VIIa[重组]-jncw 冻干粉注射剂)[/caption]药店国别:
产地国家:美国
处 方 药:是
所属类别:1毫克/瓶
包装规格:1毫克/瓶
计价单位:瓶
生产厂家中文参考译名:HEMA Biologics
生产厂家英文名:HEMA Biologics
原产地英文商品名:Sevenfact Powder Injection 1mg/vial
原产地英文药品名:coagulation factor VIIa(recombinant)-jncw
中文参考商品译名:Sevenfact冻干粉注射剂 1毫克/瓶
中文参考药品译名:凝血因子VIIa(重组)-jncw
简介:
近日,美国食品药品监督管理局(FDA)批准Sevenfact(coagulation factor VIIa[recombinant]-jncw])冻干粉注射剂,用于治疗和控制12岁及以上患有A型或B型血友病的成人和青少年的出血事件抑制剂(中和抗体)。Sevenfact包含在转基因兔子中表达的活性成分。
FDA生物学评估和研究中心主任Peter Marks博士说:“今天的批准为控制已开发出抑制剂的血友病成人和青少年的出血发作提供了另一种治疗选择。” “除了是患者的重要选择之外,Sevenfact还是血友病治疗的首款产品,其中包含从转基因兔子体内获得的活性成分,这些兔子经过基因工程改造后可产生凝血所需的蛋白质。这项批准是我们努力推动安全生物技术创新以支持患者健康的一个例子。”
血友病A或B是分别由凝血因子(F)VIII或IX的功能障碍或缺乏引起的先天性出血性疾病。血友病患者受伤或手术后流血的时间可能比其他人更长。它们还可能在肌肉,关节和器官中自发性出血,可能会危及生命。具有抑制剂的个体可能对因子替代疗法无反应。根据疾病控制与预防中心(CDC)的数据,在美国,估计有20,000人患有血友病。这些患者的出血发作可通过按需治疗或使用含FVIII或FIX的产品进行预防来控制。但是,当这些个体中出现FVIII或FIX抑制剂时,用FVIII或FIX产物治疗出血发作可能不再有效。
批准日期:2020年4月1日 公司:HEMA Biologics
SEVENFACT(凝血因子VIIa[coagulation factor VIIa[recombinant]-jncw])注射,静脉用溶液冻干粉
最初的美国批准时间:2020年
警告:血栓形成
有关完整的框内警告,请参阅完整的处方信息。
•服用SEVENFACT后可能发生严重的动脉和静脉血栓形成事件。
•与接受SEVENFACT®的患者讨论风险并解释血栓形成和血栓栓塞事件的体征和症状。
•监视患者凝血系统激活的体征或症状以及血栓形成情况。
作用机理:
SEVENFACT中的活性成分是人因子VIIa(维生素K依赖性凝血因子)的重组类似物。在钙和磷脂的存在下,与组织因子(TF)形成复合物的因子VIIa将因子X活化为因子Xa,直接绕过需要因子VIII或因子IX的反应。 因子X向因子Xa的活化启动了凝血级联反应的常见途径,在该途径中,凝血酶原被激活为凝血酶,然后凝血酶将纤维蛋白原转化为纤维蛋白以形成止血栓,从而在出血部位(止血)形成凝块。在活化血小板表面上不存在TF的情况下,也可能发生此过程。
适应症和用途:
SEVENFACT [凝血因子VIIa(重组)-jncw]是一种凝血因子VIIa浓缩物,适用于治疗和控制A或B血友病伴抑制剂的成人和青少年(12岁及以上)发生的出血事件。
使用限制:SEVENFACT不适合治疗先天性因子VII缺乏症。
用法用量:
仅在重构后用于静脉使用。
先天性血友病A或B伴有抑制剂的出血事件。
出血类型 剂量方案建议
每3小时重复75微克/公斤,直到止血为止
对于轻度或中度出血:或
初始剂量为225微克/公斤。如果在9小时
内未达到止血效果,则可根据需要每
3小时额外服用75微克/公斤剂量。
出血类型 剂量方案建议
对于严重出血: 225微克/公斤,如果需要的话,随后进行
6个小时,之后每2个小时75微克/公斤。
剂量形式和强度:
SEVENFACT可以在含有1或5mg凝血因子VIIa(重组)-jncw的单次使用小瓶中制成冻干粉。之后用指定体积的无菌注射用水配制,每毫升包含1mg(1000mcg)或凝血因子VIIa(重组)-jncw。
禁忌症:
已知对兔子或兔子蛋白过敏。对SEVENFACT或其任何成分的严重超敏反应。
警告和注意事项:
•患有血友病A或B且具有其他血栓形成危险因素的抑制剂的患者,发生严重动脉和静脉血栓形成事件的风险可能会增加。
•SEVENFACT可能会引起过敏反应,包括过敏反应。如果出现症状,患者应中止SEVENFACT并寻求适当的医学干预。
不良反应:
SEVENFACT临床试验中报告的最常见不良反应(发生率≥1%)为头痛,头晕,输液部位不适,输液部位血肿,输液相关反应和发烧。
药物相互作用:
与活化的凝血酶原复合物浓缩物同时使用时,含有FVIIa的产品在药理上的临床使用经验表明发生严重血栓事件的风险升高。
包装供应/存储和处理方式:
供应方式:
•SEVENFACT [凝血因子VIIa(重组)-jncw],以室温稳定的白色至灰白色冻干粉末形式提供,在一次性使用的小瓶中,每小瓶装一瓶。SEVENFACT的稀释剂是注射用水,以无色透明溶液的形式在预填充注射器中提供。
规格 :
每瓶1毫克 黄色 71127-1000-1 •1个1毫克SEVENFACT单药
剂量[NDC 71127-1100-1]
•1个装有1.1mL无菌注射
用水的预填充注射器
[NDC 71127-1200-1]
•1个13mm的样品瓶适
配器,带5微米过滤器
每瓶5毫克 紫色 NDC 71127-5000-1 •1个5毫克的SEVENFACT单
药合用药[NDC 71127-5100-1]
•1个装有5.2mL无菌注射用水
的预填充注射器[NDC 71127-5200-1]
•1个带有5微米过滤器的20mm样品瓶适配器
•SEVENFACT样品瓶由玻璃制成,用溴丁基橡胶塞(不是用天然橡胶乳胶制成)封闭,并用铝盖密封。
•预填充的稀释剂注射器由玻璃制成,带有硅化的溴化丁基橡胶柱塞(非天然橡胶胶乳制成)。
储存和处理:
•复溶之前,SEVENFACT试剂盒应在室温下保存,但应保存在36°F至86°F(2°C至30°C)之间,并应避开产品包装中的光线。不要冻结。
•复溶后,SEVENFACT应在室温下保存,但可以在36°F至86°F(2°C至30°C)之间存储长达4小时。 不要冷冻或存放在注射器中。
用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 凝血因子VIIa[重组]-jncw_ Sevenfact_凝血因子VIIa[重组]-jncw 冻干粉注射剂recombinant说明书
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 凝血因子VIIa[重组]-jncw_ Sevenfact_凝血因子VIIa[重组]-jncw 冻干粉注射剂recombinant说明书
![凝血因子VIIa[重组]-jncw_ Sevenfact_凝血因子VIIa[重组]-jncw 冻干粉注射剂recombinant说明书](/uploads/202210/16/221016013638235.png)